Энтропия одного моля вещества в его стандартном состоянии при соответствующей температуре называется стандартной молярной энтропией. Стандартная молярная энтропия обозначается символом S" и имеет размерность ДжК-1 моль-1. В табл. 5.12 указаны стандартные молярные энтропии ряда элементов и соединений при температуре 25°С. Отметим, что стандартная молярная энтропия газов, как правило, имеет намного большие значения по сравнению с энтропией твердых тел. Энтропия любого фиксированного количества вещества увеличивается в такой последовательности:
Твердое вещество= Жидкость= Газ
Стандартные молярные энтропии иногда называют абсолютными энтропиями. Они не являются изменениями энтропии, сопровождающими образование соединения из входящих в него свободных элементов. Следует также отметить, что стандартные молярные энтропии свободных элементов (в виде простых веществ) не равны нулю.
Третий закон термодинамике утверждает, что энтропия идеального ионного кристалла при температуре абсолютного нуля (О К) равна нулю.
Таблица 5.12. Стандартные молярные энтропии S°(298 К) (Дж/(К моль))
| Твердые вещества | Жидкости | Газы | |||
| С (алмаз) | 2,4 | H2O | 69,9 | H2 | 131,0 |
| Cu | 33,1 | Hg | 76,0 | CH4 | 186,2 |
| SiO2 | 41,8 | Br2 | 156,6 | O2 | 205,0 |
| CuO | 43,5 | C2H5OH | 160,7 | CO2 | 213,6 |
| I2 | 116,8 | C6H6 | 173,3 | Cl2 | 233,0 |
| CuSO4 •5H2O | 360,2 | CHCl3 | 201,8 | NO2 | 239,9 |
Изменение стандартной молярной энтропии в химической реакции определяется уравнением

9)Энергия Гиббса. Стандартные значения свободной энергии. Изменение свободной энергии в химической реакции.
Энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на принципиальную возможность химической реакции; это термодинамический потенциал следующего вида:
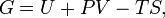 где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S —энтропия.
где U — внутренняя энергия, P — давление, V — объем, T — абсолютная температура, S —энтропия.
 2018-01-21
2018-01-21 1786
1786
