Химические понятия
Вещество – форма материи, которая имеет массу покоя.
Поле – форма материи, которая не имеет массы покоя.
Движение (явление) – любое изменение материи.
Молекула – это наименьшая частица вещества, которая сохраняет его состав и химические свойства. Молекулы одного вещества одинаковы. Молекулы различных веществ отличаются друг от друга весом, размерами и химическими свойствами.
Молекулы непрерывно движутся.
Молекулы состоят из атомов.
Атомы – это мельчайшие частицы, которые не распадаются при химических реакциях.
Атомы одного вида, отличаются от атомов других видов весом, размерами и химическими свойствами.
Химический элемент – вид атомов с одинаковым зарядом ядра. Известно 110 химических элементов, изучено 105.
Простое вещество–форма существования элемента в свободном состоянии. Молекулы простых веществ состоят из атомов одного элемента.
Многие химические элементы образуют несколько простых веществ. Например, элемент кислород (О) образует два различных вещества: кислород (О2) и озон (О3). Элемент углерод (С) образует тоже два простых вещества: алмаз и графит. Такое явление называют аллотропией, а каждое из этих простых веществ – аллотропным видоизменением (модификацией) данного элемента. Явление аллотропиии в одних случаях обусловлено тем, что молекулы различных аллотропических видоизменений состоят из различного числа атомов, а в других случаях тем, что их кристаллы имеют различное строение.
Сложные вещества – это такие вещества, молекулы которых состоят из атомов различных элементов. Например, вода (Н2О) состоит из атомов элементов водорода и кислорода. Но нельзя говорить, что вода состоит из простых веществ водорода и кислорода.
Ион – электрически заряженная частица, которая образуется вследствие отщепления или присоединения электронов (K+, Fe2+, SO4).
Физические явления – форма движения материи, при которой не изменяются состав и структура вещества.
При физических явлениях изменяются отдельные свойства: форма, объем, положение тел, агрегатное состояние веществ. Например, вода при нагревании превращается в пар, а при охлаждении в лед. Это физическое явление.
Если мы разотрем мел в порошок, он не превратится в новое вещество.
Если мы нагреем стеклянную трубку, она станет мягкой, изменит форму, но стекло не превратится в новое вещество. Растирание мела, изменение формы трубки – это физические явления.
При физических явлениях одни вещества не превращаются в другие.
Химическое явление – форма движения материи, при которой происходит изменение состава и структуры реагирующих веществ. Если мы положим мел в пробирку и нальем в нее кислоту, получаются новые вещества. Сера горит и превращается в новое газообразное вещество, которое имеет неприятный запах.
Превращение мела и кислоты в новые вещества, горение серы, дерева – это химические явления (химические реакции).
При химических явлениях одни вещества превращаются в другие.
Атомная и молекулярная масса
Абсолютные массы атомов и молекул очень малы. Так, абсолютная масса атома водорода равна 1,67×10-24 грамма.
Один атом кислорода весит 26,6×10-24 г. Один атом углерода весит 19,93×10-24 г. Один атом железа весит 93,13×10-24 г.
Пользоваться этими числами при расчетах очень неудобно. Поэтому в химии и физике всегда пользуются относительными атомными и молекулярными массами. (Аг, Мг).
Атомная масса элемента измеряется в атомных единицах массы (а.е.м.). Атомная единица массы – это ½ часть массы углерода (изотопа12С).
Атомная единица массы равна 1,66×10-24 грамма.
Вычислим относительную атомную массу водорода:
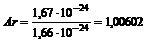 а.е.м.
а.е.м.
Атомную массу химического элемента можно определить по таблице Д.И.Менделеева.
Молекулярная масса вещества (Мг) равна сумме атомных масс всех атомов, входящих в состав данной молекулы.
Молекулярная масса тоже измеряется в атомных единицах массы. Молекулярную массу можно найти по формуле вещества.
Вычислим молекулярную массу серной кислоты. Формула серной кислоты H2SO4.
1.Определим по таблице атомную массу водорода, серы и кислорода: Аг(Н) = 1 а.е.м; Аг(S) = 32 а.е.м; Аг(О) = 16 а.е.м.
2. По определению, молекулярная масса серной кислоты равна сумме атомных масс всех атомов водорода, серы и кислорода, которые содержатся в молекуле. Запишем Мг(H2SO4) = (1 а.е.м. ´2) + 32 а.е.м. + (16 а.е.м. ´ 4) = 98 а.е.м.
В международной системе единиц СИ за единицу измерения количества вещества принят моль.
Моль – это количество простого или сложного вещества, которое содержит 6,02×1023 структурных единиц (молекул, атомов, ионов, электронов, нейтронов, протонов), т.е. столько, сколько атомов содержится в 12 г (0,012 кг) изотопа углерода 12(12С).
6,02×1023 – называется числом Авогадро (Na) и имеет размерность 1/моль. Na = 6,02×1023
Масса 1 моля вещества называется молярной (или мольной) массой М.
Она равна произведению массы структурной единицы вещества (молекулы, атома, иона) в граммах на число Авогадро (Na) в 1/моль.
Поэтому молярная масса М имеет размерность г/моль; кг/моль.
Молярная (мольная) масса молекул вещества численно равна относительной молекулярной массе.
А молярная масса атомов – относительной атомной массе.
Молярная масса ионов – сумме относительных атомных масс элементов, входящих в них.
Так, например, молярная масса молекулы водорода равна
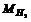 = 2 г/моль.
= 2 г/моль.
Молярная масса атомов водорода 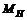 = 1 г/моль.
= 1 г/моль.
Молярная масса сульфат – иона (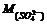 ) = 96 г/моль.
) = 96 г/моль.
Количество молей данного вещества (n) с молярной массой М связано с массой вещества m (г) соотношением:

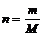 или
или 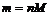
следовательно молярная масса – это соотношение массы вещества к количеству вещества, т.е.
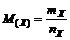
 2018-01-21
2018-01-21 2410
2410