при T®0,S®0,следовательно, абсолютный нуль температур недостижим.
В инженерной практике, начало отсчета энтропии может быть выбрано произвольно. Условились, за начало отсчёта энтропии (состояние 1) принимать нормальные физические условия (НФУ.):
pн=101325 Па, Tн=273.15 K.
Таким образом, при НФУ S1=0.
Опуская индекс 2, получаем формулу для вычисления величиныэнтропии:
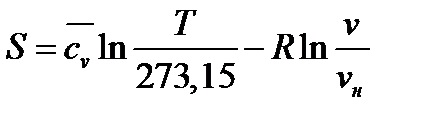 (110)Плюс!!!
(110)Плюс!!!
Здесь vн – удельный объём при нормальных физических условиях.
Из уравнения состояния идеального газа в форме pнvн=RTн,
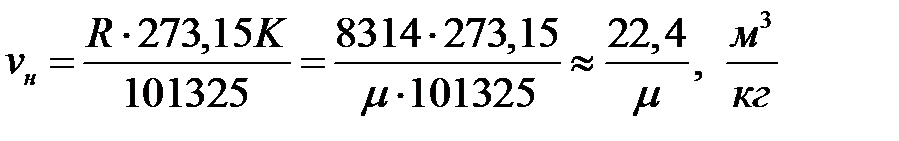
Здесь µ - молекулярная масса газа.
Как известно, по закону Авогадроодинкиломоль любого газа при одинаковых условиях занимает один и тот же объём, в частностипри НФУ-22,4 м3.
Во всех вышеприведённых формулах массовая изохорная теплоёмкость cv бралась средним значением, то есть 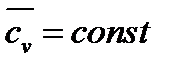 .
.
б) пусть cv=c0v+aT, то есть удельная изохорная теплоемкость линейно зависит от температуры
Тогда
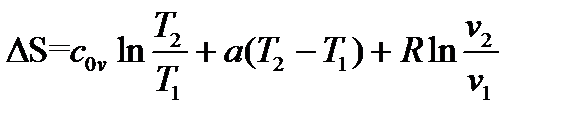
|
Из этой формулы, применимой для любого процесса идеального газа,
следуют два частных случая:
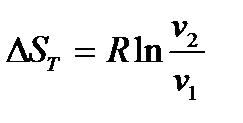 и
и 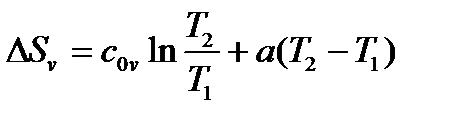
Формула для вычисления величины удельной энтропии:
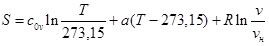
|
Вторая группа формул для расчета энтропии идеального газа(при S =S(T,P)

|
а) При 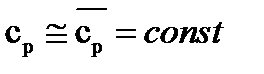
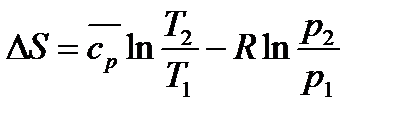
|
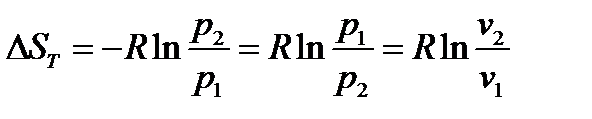
|
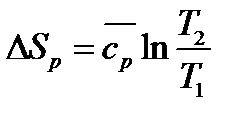
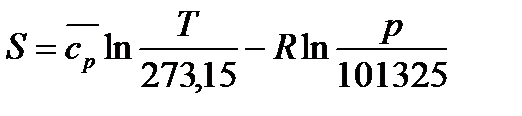
б) При ср=с0р+аТ
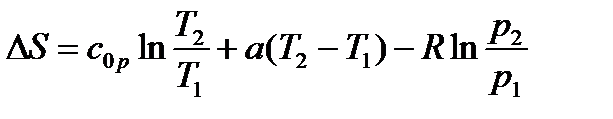
|
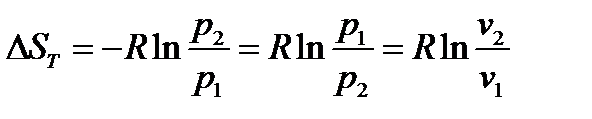
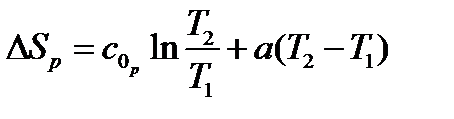
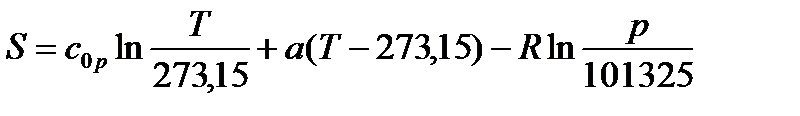
|
Третья группа формул для расчета энтропии идеального газа(при S=S(p,v)):
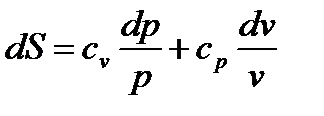
|
а) При 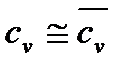 и
и 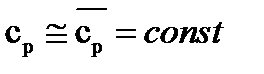
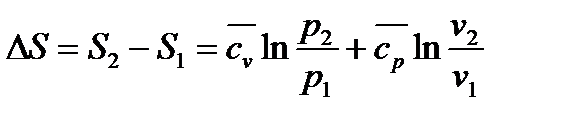
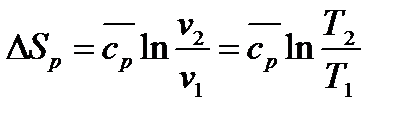
|
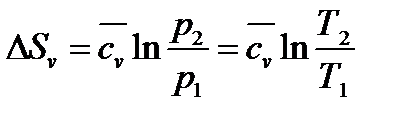
|
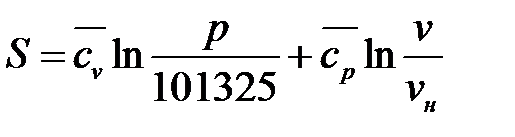
б) При cv=c0v+aT и ср=с0р+аТ
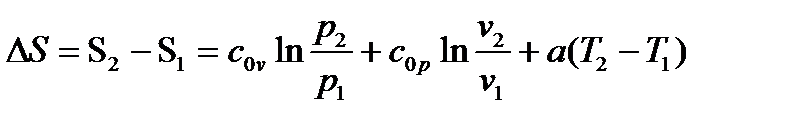
|
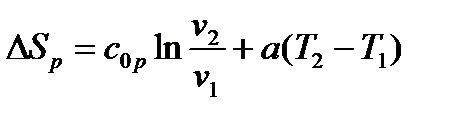
|
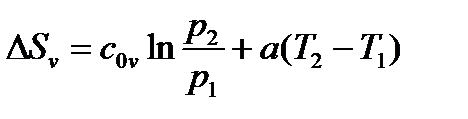
|
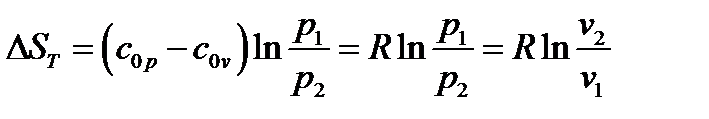
|
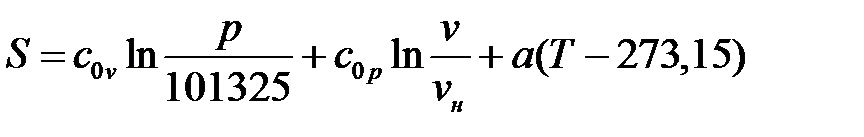
|
 2018-01-21
2018-01-21 706
706








