Перекрывание АО. s-связь. p- и d-связь:
При описании электронного строения химической частицы электроны, в том числе и обобществленные, относят к отдельным атомам и их состояния описывают атомными орбиталями. При решении уравнения Шредингера приближенную волновую функцию выбирают так, чтобы она давала минимальную электронную энергию системы, то есть наибольшее значение энергии связи. Это условие достигается при наибольшем перекрывании орбиталей, принадлежащей одной связи. Таким образом, пара электронов, связывающих два атома, находится в области перекрывания их атомных орбиталей.
Перекрываемые орбитали должны иметь одинаковую симметрию относительно межъядерной оси. Перекрывание атомных орбиталей вдоль линии, связывающей ядра атомов, приводит к образованию σ-связей. Между двумя атомами в химической частице возможна только одна σ-связь. Все σ-связи обладают осевой симметрией относительно межъядерной оси. Фрагменты химических частиц могут вращаться вокруг межъядерной оси без нарушения степени перекрывания атомных орбиталей, образующих σ-связи. Совокупность направленных, строго ориентированных в пространстве σ-связей создает структуру химической частицы.
|
|
|
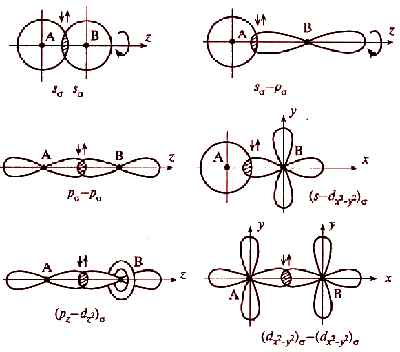
При дополнительном перекрывании атомных орбиталей, перпендикулярных линии связи, образуются π-связи:
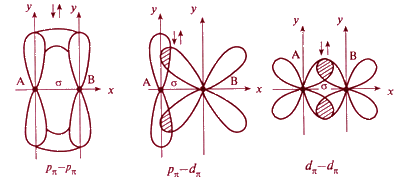
С появлением π-связи, не имеющей осевой симметрии, свободное вращение фрагментов химической частицы вокруг σ-связи становится невозможным, так как оно должно привести к разрыву π-связи. Помимо σ- и π-связей, возможно образование еще одного вида связи - δ-связи.
Обычно такая связь образуется после образования атомами σ- и π-связей при наличии у атомов d - и f -орбиталей путем перекрывания их "лепестков" сразу в четырех местах. В результате кратность связи может возрасти до 4-5.
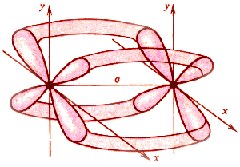 Например, в октахлородиренат(III)-ионе [Re2Cl8]2- между атомами рения образуются четыре связи.
Например, в октахлородиренат(III)-ионе [Re2Cl8]2- между атомами рения образуются четыре связи.
Валентные углы:
Валентный угол — угол, образованный направлениями химических связей, исходящими из одного атома. Знание валентных углов необходимо для определения геометрии молекул. Валентные углы зависят как от индивидуальных особенностей присоединенных атомов, так и от гибридизации атомных орбиталей центрального атома. Для простых молекул валентный угол, как и другие геометрические параметры молекулы, можно рассчитать методами квантовой химии. Экспериментально их определяют из значений моментов инерции молекул, полученных путем анализа их вращательных спектров (смотри Инфракрасная спектроскопия, Молекулярные спектры, Микроволновая спектроскопия). Валентный угол сложных молекул определяют методами дифракционного структурного анализа.
|
|
|
Строение молекул. ОВЭП (Джиллеспи). Химическое строение молекул. Центральный и периферические атомы (лиганды). Координационное число. Представление о локализованных валентных электронных парах (ЛВЭП). Валентные связанные (ВСЭП) и неподеленные (ВНЭП) электронные пары. Стерическое число (СЧ). Формы правильных симплексов для различных СЧ. Факторы, влияющие на величины валентных углов: взаимное отталкивание ВСЭП и ВНЭП, кратность связи, соотношение электроотрицательностей атомов и их размеры. Дипольные моменты молекул.
Строение молекул:
Строение молекул (молекулярная структура) - взаимное расположение атомов в молекулах. В ходе химических реакций происходит перегруппировка атомов в молекулах реагентов и образуются новые соединения. Поэтому одна из фундаментальных химических проблем состоит в выяснении расположения атомов в исходных соединениях и характера изменений при образовании из них других соединений. Первые представления о структуре молекул основывались на анализе химического поведения вещества. Эти представления усложнялись по мере накопления знаний о химических свойствах веществ. Применение основных законов химии позволяло определить число и тип атомов, из которых состоит молекула данного соединения; эта информация содержится в химической формуле. Со временем химики осознали, что одной химической формулы недостаточно для точной характеристики молекулы, поскольку существуют молекулы-изомеры, имеющие одинаковые химические формулы, но разные свойства. Этот факт навел ученых на мысль, что атомы в молекуле должны иметь определенную топологию, стабилизируемую связями между ними. Впервые эту идею высказал в 1858 немецкий химик Ф.Кекуле. Согласно его представлениям, молекулу можно изобразить с помощью структурной формулы, в которой указаны не только сами атомы, но и связи между ними. Межатомные связи должны также соответствовать пространственному расположению атомов. Этапы развития представлений о строении молекулы метана отражены на рис. 1. Современным данным отвечает структура г: молекула имеет форму правильного тетраэдра, в центре которого находится атом углерода, а в вершинах - атомы водорода.
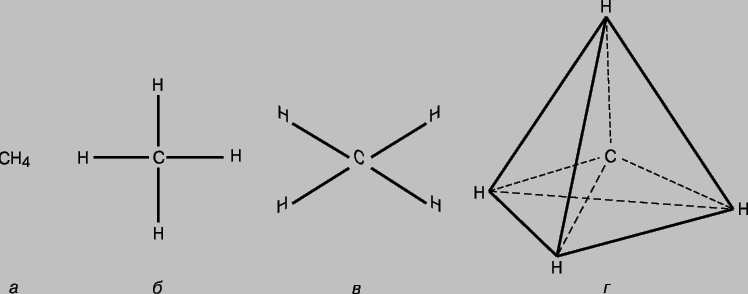
Рис. 1. ЧЕТЫРЕ СПОСОБА ИЗОБРАЖЕНИЯ МОЛЕКУЛЫ МЕТАНА.а - химическая формула. Указаны лишь число и тип атомов; б - структурная формула; в - реальная схема молекулы; г - пространственное расположение атомов в молекуле.
ОВЭП (Джиллеспи):
В 1940 г. Н. Сиджвик и Г. Пауэлл предложили модель отталкивания электронных пар, которая впоследствии была развита (1957) Р. Гиллеспи и Р. Найхолмом. Основные идеи этого подхода, приложимого только к соединениям непереходных элементов, сводятся к следующему:
1. Конфигурация связей многовалентного атома (или иона) обусловливается исключительно числом связывающих и несвязывающих электронных пар в валентной оболочке центрального атома.
2. Ориентация облаков электронных пар валентных орбиталей определяется максимальным взаимным отталкиванием заполняющих их электронов.
Химическое строение молекул:
В классической теории химического строения молекула рассматривается как наименьшая стабильная частица вещества, обладающая всеми его химическими свойствами.
Молекула данного вещества имеет постоянный состав, то есть одинаковое количество атомов, объединённыххимическими связями, при этом химическая индивидуальность молекулы определяется именно совокупностью и конфигурацией химических связей, то есть валентными взаимодействиями между входящими в её состав атомами, обеспечивающими её стабильность и основные свойства в достаточно широком диапазоне внешних условий. Невалентные взаимодействия (например, водородные связи), которые зачастую могут существенно влиять на свойства молекул и вещества, образуемого ими, в качества критерия индивидуальности молекулы не учитываются.
|
|
|
Центральным положением классической теории является положение о химической связи, при этом допускается наличие не только двухцентровых связей, объединяющих пары атомов, но и наличие многоцентровых (обычно трёхцентровых, иногда — четырёхцентровых) связей с «мостиковыми» атомами — как, например, мостиковых атомов водорода в боранах, природа химической связи в классической теории не рассматривается — учитываются лишь такие интегральные характеристики, как валентные углы, диэдральные углы (углы между плоскостями, образованными тройками ядер), длины связей и их энергии.
Центральный и периферические атомы (лиганды):
Лига́нд (от лат. ligare — связывать) — атом, ион или молекула, связанные с неким центром (акцептором). Понятие применяется в биохимии для обозначения агентов, соединяющихся с биологическими акцепторами (рецепторами, иммуноглобулинами), а также в химии комплексных соединений, обозначая там присоединенные к одному или нескольким центральным (комплексообразующим) атомам металла частицы.
Чаще всего такое связывание происходит с образованием так называемой «координационной» донорно-акцепторной связи, где лиганды выступают в роли основания Льюиса, то есть являются донорами электронной пары. При присоединении лигандов к центральному атому химические свойства комплексообразователя и самих лигандов часто претерпевают значительные изменения.
Номенклатура лигандов:
1. первым в названии соединения в именительном падеже называется анион, а затем в родительном — катион
2. в названии комплексного иона сначала перечисляются лиганды в алфавитном порядке, а затем центральный атом
3. центральный атом в нейтральных катионных комплексах называются русским названием, а в анионах корнем латинского названия с суффиксом «ат». После названия центрального атома указывается степень окисления.
|
|
|
4. число лигандов, присоединенных к центральному атому, указывается приставками «моно», «ди», «три», «тетра», «пента», и т. д.
Собственно, важнейшая характеристика лиганда, позволяющая оценить и спрогнозировать его способности к комплексообразованию и саморазрушению D-орбитали — разрушения соединения в целом. В первом приближении включает в себя количество электронных пар, которые лиганд способен выделить на создание координационных связей и электроотрицательность донирующего атома или функциональной группы.
В химии понятие координационного числа появилось с развитием химии комплексных соединений. Под ним подразумевается число лигандов (атомов, молекул, ионов), которые образуют первую координационную (внутреннюю) сферу комплексообразователя.
Например, в комплексной соли гексацианоферрате(III) калия K3[Fe(CN)6] координационное число иона Fe3+ равно 6, а в цис-дихлородиамминплатине (II) (соли Пейроне) Pt(NH3)2Cl2 центральный атом платины связан с четырьмя лигандами.
Понятие координационного числа применяется и для характеристики центрального атома в молекулах, преимущественно для тех случаев, когда число химических связанных ближайших атомов не равно численному значению валентности. Например, в молекуле азотной кислоты формальная валентность центрального атома азота равна 4, степень окисления - +5, а координационное число - 3.
Понятие координационного числа применяется также при описании структуры жидкостей и аморфных тел. В этом случае координационное число — мера ближнего порядка, среднее число ближайших соседей атома. Оно может быть дробным.
Представление о локализованных валентных электронных парах (ЛВЭП):
Согласно теории локализованных пар, общая картина распределения электронной плотности в молекулах типа MX k складывается из независимых фрагментов М — X, связь в каждом из которых осуществлена парой электронов (по одному от центрального атома М и от заместителя X), локализованной между двумя атомами М и X. Согласно этой теории В. не просто связывается с наличием неспаренного электрона, но и характеризуется тем, в каком состоянии этот электрон находится или, в терминах теории химической связи, какую атомную орбиталь (АО) он занимает. АО разного типа имеют различную ориентацию в пространстве: s-орбиталь сферически симметрична, орбитали px, ру и pz вытянуты вдоль трёх взаимно перпендикулярных осей и т.д. Электроны атомов в молекулах в общем случае описываются «гибридными» (смешанными) орбиталями, в которые, в принципе, могут входить любые валентные АО в разных количественных соотношениях и у которых электронные облака сконцентрированы вдоль направлений связей М — Х значительно сильнее, чем у простых АО. Состояние валентных электронов, а следовательно и свойства Валентности атома М, в значительной мере определяют закономерности в свойствах молекул MX k для широкого круга заместителей X. Наиболее плодотворными оказались концепции направленных Валентностей и валентных состояний атомов, позволившие объяснить и обобщить ряд закономерностей в геометрическом строении и энергиях химических связей органических и неорганических молекул.
Валентные связанные (ВСЭП) и неподеленные (ВНЭП) электронные пары:
В комплексных соединениях координационное число центрального атома часто больше числа электронов в его валентной оболочке. Важную роль здесь играют Донорно-акцепторная связь и дативные связи, образующиеся за счёт неподелённой электронной пары (то есть пары электронов с противоположными спинами, занимающих одну АО) одного атома и пустой орбитали другого. Соответственно должны быть расширены и представления о Валентности: способность к образованию связей, а следовательно и Валентность атома, обусловливается не только неспаренными электронами, но и неподелёнными парами и пустыми орбиталями валентной оболочки. Наибольшая суммарная Валентность должна быть равна числу всех АО, составляющих валентную оболочку атома, поскольку каждая валентная АО, независимо от того, сколькими электронами она заселена у атома в валентном состоянии, потенциально способна образовать одну связь (гайтлер-лондоновскую, донорно-акцепторную или дативную). В рамках этой концепции максимальная Валентность всех элементов второго периода от Li до F равна 4 (одна s -opбиталь + три р -орбитали), у элементов следующих периодов — 9 (за счёт ещё пяти d -opбиталей) и т.д. Решение же вопроса о том, какие из этих четырёх или девяти Валентностей насыщаются и какие остаются неиспользованными, в соединениях каждого конкретного типа определяется не только свойствами самого атома и его положением в периодической системе, но и особенностями соединения в целом. Полный ответ на него может быть получен с помощью квантовохимических расчётов. За счёт донорно-акцепторного взаимодействия фактическое число связей атома (а следовательно и его Валентность) в комплексных и даже в простых соединениях в общем случае может быть больше не только числа его неспаренных электронов, но и числа связанных с ним соседних атомов.
Стерическое число(СЧ). Формы правильных симплексов для различных СЧ:
Для удобства далее будем обозначать центральный атом какА, заместители –Х, неподеленные электронные пары (ЭП). Полезно ввести понятие стерического числа (СЧ), равногосумме количества заместителей и неподелённых пар.
Количество ближайших к выделенному атому соседних атомов (ближайших соседей) называют координационным числом(КЧ). Для частиц с ковалентными связями КЧ равно числу σ-связей.
Иначе для многоатомной частицы СЧ = n + m илиравно сумме координационного числа и числа неподеленных парцентрального атома. Для рассмотренных примеров СЧ = 2 + 0 = 2для ВеСl2, и 3 = 2 + 1 для SnСl2. Достаточно очевидно, что если вцентр многогранника поместить центральный атом А, то для значений СЧ, равного 4, ЭП должны располагаться по вершинам тетраэдра; для СЧ = 5 – по вершинам тригональной бипирамиды; для СЧ = 6
– по вершинам октаэдра.
Факторы, влияющие на величины валентных углов:
Величины валентных углов зависят от природы атомов и характера связи. Простые двухатомные молекулы всегда имеют линейную структуру. Трехатомные и более сложные молекулы могут обладать различными конфигурациями. Например, в молекуле воды угол между линиями связи Н—О равен 104,5°, а в сходной молекуле сероводорода валентный угол между связями составляет 92°.
Взаимное отталкивание ВСЭП и ВНЭП:
Неподеленная электронная пара занимает больший объем, чем пара электронов на орбитали, участвующей в образовании ординарной связи. Сила отталкивания электронных пар в данной валентной оболочке понижается в следующем порядке: неподеленная пара — неподеленная пара (Е — Е) > неподеленная пара — связывающая пара (Е—X) > связывающая пара — связывающая пара (X—X).
Кратность связи:
Кратность связи - число электронных пар, обобществлённых двумя соседними атомами молекулы в результате ковалентной химической связи. Так, в молекуле этана Н 3 С-СН 3 связь С-С одинарная, К. с. равна единице (одна общая пара электронов); в молекуле этилена Н2 С = СН 2 связь С = С двойная, К. с. равна двум (две - пары обобществлённых электронов); в молекуле ацетилена НС  СН тройная связь с тремя обобществлёнными парами электронов. Чем выше К. с., тем, как правило, меньше её длина и выше прочность. Ср. длина связи С-С в органических соединениях 0,154 нм, С=С - 0,133 нм и С
СН тройная связь с тремя обобществлёнными парами электронов. Чем выше К. с., тем, как правило, меньше её длина и выше прочность. Ср. длина связи С-С в органических соединениях 0,154 нм, С=С - 0,133 нм и С  С - 0,121 нм. Прочность связи соответственно выше у связи С
С - 0,121 нм. Прочность связи соответственно выше у связи С  С.
С.
К. с. не всегда выражается целым числом. Так, в молекуле бензола С 6 Н 6 все связи углерод=углерод одинаковы и длины их равны 0,140 нм. Считается, что К. с. С-С в молекуле бензола равна 1,5. В металлоорганических и комплексных соединениях К. с. выражается дробным числом, а иногда и вовсе не поддаётся однозначному определению.
Соотношение электроотрицательностей атомов и их размеры:
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселённости, т. е. от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остаётся необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности, силовую постоянную и т. д.
Дипольные моменты молекул:
Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами в пространстве. В зависимости от полярности молекул характер межмолекулярного взаимодействия разный. Природа последнего оставалась неясной до создания квантовой механики.
Ориентационный тип межмолекулярного взаимодействия возникает между двумя полярными молекулами, то есть, такими, которые имеют собственный дипольный момент. Взаимодействие дипольных моментов и определяет результирующую силу — притяжения или отталкивания. В случае, если дипольные моменты молекул размещаются на одной линии, взаимодействие молекул будет интенсивней.
Индукционный тип межмолекулярного взаимодействия возникает между одной полярной и одной неполярной молекулами. При этом типе взаимодействия полярная молекула поляризует неполярную молекулу так, что заряд неполярной молекулы, противоположный действующему на неё заряда полярной молекулы, смещается до последнего: в общем, положительный заряд смещается по направлению электрического поля, которое создает полярная молекула, а отрицательный — против. Это обусловливает поляризацию неполярной молекулы, то есть явления смещения связанной электронной оболочки относительно центра положительного заряда.
Дисперсионный тип межмолекулярного взаимодействия возникает между двумя неполярными молекулами. В общем, дипольные моменты неполярных молекул равны нулю, однако в определенный момент времени, есть вероятность распределения электронов по всему объёму молекулы неравномерно. Вследствие этого возникает мгновенный дипольный момент. При этом, мгновенный диполь или поляризует соседние неполярные молекулы, или взаимодействует с мгновенным диполем другой нейтральной молекулы.
 2018-01-21
2018-01-21 4128
4128
