Строение атома: ядерная модель Резерфорда, теория Планка, основные положения теории Бора, предположения Л. Де Бройля.
Одна из первых моделей была предложена Резерфордом в 1910 году, согласно этой модели атом состоит из положительного заряженного ядра и отрицательно заряженного электрона, вращающегося вокруг ядра.
В 1900 году М. Планк показал, что способность нагретого тела к лучеиспусканию можно описать предположив, что энергия, выделяемая телом (или поглощаемая) выделяется порциями или квантами 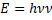 –частота испускания. Энергия тела может меняться на величины
–частота испускания. Энергия тела может меняться на величины 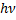 .
.
Электрон переходя из одного энергетического состояния в другое излучает энергию. В 1924 году Л. Де Броль высказал идею, что материя обладает, как волновыми, так и корпускулярными свойствами 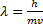 .
.
В 1913 году Нильс Бор предложил теорию строения атома по Бору. Согласно его теории движение электрона в вакууме ограниченна устойчивой орбитой. Эти орбиты называются стационарными. До тех пор пока электрон находится на орбите он не излучает энергию.
|
|
|
2) Способы выражения концентрации растворов. Химический эквивалент.
Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называют концентрацией. Способы:. Моль является единицей измерения кол-ва в-ва. Моль-кол-во в-ва, которое содержит 6,022*1023 структурных единиц (молекул, атомов, ионов, электронов и др.).молярная масса (М) масса одного моля в-ва в г/моль. Эквивалент – реальная или условная частица, которая соответствует одному иону Н кислотно-основных или ионообменных реакциях, или одному электрону окислительно-восстановительных реакциях. Моль-эквивалентов (νэ) – кол-во в-ва, которое содержит 6,022*1023 эквивалентов.νэ=m/Mэ. Молярная масса эквивалентного в-ва (Мэ) – масса одного моль эквивалента. Мэ (простого в-ва)=Ма/В г/моль. Мэ
(сложного в-ва) = М/n*В, где В-валентность, n-кол-во функцион. групп. Функциональная группа – группа, присущая данному классу. Для кислоты – Н, для основания – ОН, для соли – ион металла. Объем моль – эквивалентов. Vэ для его вычисления необходимо знать молярную массу эквивалента гаа. Закон эквивалента. Закон эквивалента гласит в-ва взаимодействуют друг с другом в эквивалентных соотношениях, т. е. масса в-ва, реагирующих друг с другом или получающихся в результате реакции пропорциональны молярным массам их эквивалентов (тверд.в-ва):m1/m2=Mэ1/Мэ2m1/Мэ1=m2/Мэ2. Для реагирующих в-в, находящихся в растворе закон эквивалентов: N1*V1=N2*V2–растворы. N1, N2 –нормальные концентрации растворов.V1, V2–объемы реагирующих растворов.V1/Vэ1=V2/Vэ2 – для газов.
Строение многоэлектронных атомов: правило Клечковского, принцип Паули, правило Хунда. Связь электронного строения атома со свойствами химических элементов.
|
|
|
Правило Клечковского: Энергия электрона в основном определяется суммой значений главного квантового числа и орбитального. Поэтому сначала заполняются те подуровни, для которых сумма значений квантовых чисел является наименьшей. Если два подуровня обладают суммой значений n+l равной, то сначала заполняется подуровень с меньшим значением n. По правилу Клечковского подуровни заполняются:1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 5d, 4f, 6p…
Правило Хунда: подуровни p,d,f – орбитали сначала заполняются одиночными электронами и лишь затем происходит заполнение вторыми электронами, так называемое спаривание. а) 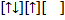 б)
б) 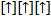 второе состояние б) является предпочтительней, однако в сложных молекулах (кристаллах) правило Хунда не всегда соблюдается.
второе состояние б) является предпочтительней, однако в сложных молекулах (кристаллах) правило Хунда не всегда соблюдается.
Принцип Паули: На одной орбитали могут находится только 2 электрона с противоположными спинами. Принцип Паули запрещает нахождение на той же орбитали третьего электрона, так как это бы означало, что у двух электронов все 4 квантовых числа одинаковы.
 2018-01-21
2018-01-21 647
647







