Энтропия – степень беспорядка, обозначается S. Связь энтропии с молекулярным хаосом описал Людвиг Больцман уравнением: 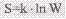 . Постулат Планка (3 закон термодинамики) – при абсолютном нуле энтропия чистого кристаллического в-ва без дефектов в кристаллической решетке = 0. Изменение энтропии для изотермических процессов определяется уравнением:
. Постулат Планка (3 закон термодинамики) – при абсолютном нуле энтропия чистого кристаллического в-ва без дефектов в кристаллической решетке = 0. Изменение энтропии для изотермических процессов определяется уравнением: 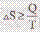 , при этом знак неравенства относится к необратимым процессам, а равенства – к необратимым. Стандартная энтропия =
, при этом знак неравенства относится к необратимым процессам, а равенства – к необратимым. Стандартная энтропия = 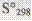 , и давление = 1атм. Значение энтропии может быть найдено с использованием следствия из закона Гесса, по формуле:
, и давление = 1атм. Значение энтропии может быть найдено с использованием следствия из закона Гесса, по формуле:  . В изолированных с-мых самопроизвольно могут совершаться процессы, при которых энтропия с-мы возрастает, т.е. ▲S>0ю Зависимость энтропии – 1)от агрегатного состояния (увеличивается от перехода твердого к жизкому и к газообразному), 2)чем выше t, тем сильнее проявляется стремление системы к беспорядку.
. В изолированных с-мых самопроизвольно могут совершаться процессы, при которых энтропия с-мы возрастает, т.е. ▲S>0ю Зависимость энтропии – 1)от агрегатного состояния (увеличивается от перехода твердого к жизкому и к газообразному), 2)чем выше t, тем сильнее проявляется стремление системы к беспорядку.
 2017-11-01
2017-11-01 349
349







