Осмос -явление одностороннего проникновения молекулы растворителя через полунепроницаемую мембрану в сторону градиента концентрации
Осотич давл-величина измеряемая минимальным гидравлическим давл, кот нужно приложить к р-ру чтоб осмос прекратился
Для растворов электролитов необходимо учитывать изотонический коэффициент Вант-Гоффа 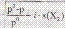
Роль осмоса в биологии и медицине.
Благодаря осмосу регулируется поступление воды в к-ки, тургор обеспечивается также осмотическим давлением. Растворы, имеющие одинаковое осмотическое давление – изотонические. Если 2 раствора имеют различное осм.давл., то раствор с большим – гипертонический, а второй – гипотонический по отношению к первому.

Б-лизис, в-плазмолиз. Гемолиз – отсутствие эритроцитов в крови.
Растворы электролитов. Электролитическая диссоциация.
Растворы электролитов – р-ры диссоциирующих на ионы солей, кислот, оснований, амфолитов.
Электролитическая диссоциация - это распад молекул электролитов на ионы в растворителях (ионизация).Процесс диссоциации необратим. Электролиты, которые практически полностью диссоциируют на ионы – сильные, которые не полностью – слабые.
|
|
|
Диссоциация в растворах слабых электролитов
Слабые электролиты – большинство орг. Кислот и некоторые неорг. Соедин., н-р – H2S, HClO. На степень диссоциации слабых эл. Влияет добавление одноименных ионов – уменьшает ст. дисооциации, атакже концентрация р-ра. Закон разведения Оствальда – степень диссоциации слабого электролита возрастает с разбавлением раствора. Сильные электролиты не подчиняются этому закону. Если эл. Диссоциации – с поглощением теплоты, то с повышением температуры она увеличивается.
 2017-11-01
2017-11-01 2948
2948








