По современным представлениям, свет это поток частиц электромагнитного поля, называемых фотонами и имеющих двойственные корпускулярно-волновые свойства (т.е. свет обладает свойствами потока частиц и волн). Основной характеристикой световых волн является частота колебаний ν (частота колебаний векторов напряженностей Е и Н электромагнитного поля). Чаще используется связанная с ней длина волны в вакууме λ = сТ = c/ν, где с - скорость света в вакууме округленно принимается с = 3•108 м/с, Т – период колебания.
В соответствии с условиями возбуждения и свойствами излучения электромагнитные волны делятся по частоте (или длине волны) на несколько диапазонов, составляющих шкалу электромагнитных волн: радиоволны, оптическое излучение, рентгеновское излучение, гамма-излучение. Границы этих диапазонов условны, так как они в значительной мере определяются источниками излучения и поэтому могут взаимно перекрываться (рис.1).

Рис.1
 |
| Рис.2. |
Электромагнитное излучение с длинами волн в пределах от 400 мкм до 10 нм называется оптическим излучением. Оптическое излучение в пределах длин волн от 760 до 380 нм, действуя на глаз, вызывает ощущение света. Оно называется видимым излучением. В сторону более длинных волн от него в спектре расположено невидимое инфракрасное излучение, в сторону более коротких волн - невидимое ультрафиолетовое.
Излучение может быть простым (или монохроматическим) и сложным. Монохроматическим называется излучение какой-либо одной длины волны. Это идеализированное представление; практически монохроматическим считают такое излучение, в котором длины составляющих его волн различаются не больше чем на десятые доли нанометра. Монохроматическое излучение в видимой части спектра определенной длины волны, действуя на глаз, вызывает ощущение соответствующего цвета. Излучение, состоящее из волн различной длины, называется сложным. В зависимости от его спектрального состава оно может вызывать различные цветовые ощущения,
 |
| Рис.3 |
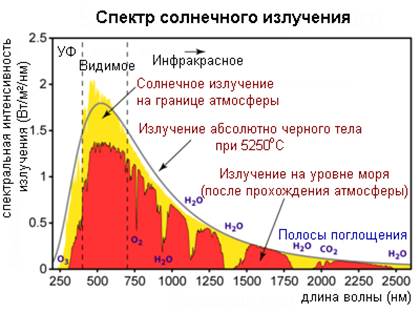
Среди множества возможных видов сложного излучения выделяют белый свет. Белым светом называют видимую часть излучения Солнца (рис.2), а также излучения нагретых до высокой температуры (несколько тысяч градусов) непрозрачных твердых и жидких тел. Это излучение содержит все волны видимого диапазона в определенном соотношении по интенсивности.
Спектр.
Спектр электромагнитного излучения это упорядоченная по длинам совокупность монохроматических волн, на которую разлагается свет или иное электромагнитное излучение. Типичный пример спектра – хорошо известная всем радуга. Возможность разложения солнечного света на непрерывную последовательность лучей разных цветов впервые экспериментально показал И.Ньютон в 1666. Направив на трехгранную призму узкий пучок света (рис.3), проникавший в затемненную комнату через маленькое отверстие в ставне окна, он получил на противоположной стене изображение окрашенной полоски с радужным чередованием цветов, которая была названа им латинским словом spectrum. Проводя опыты с призмами, Ньютон пришел к следующим важным выводам: 1) обычный «белый» свет является смесью лучей, каждый из которых имеет свой собственный цвет; 2) лучи разных цветов, преломляясь в призме, отклоняются на различные углы, вследствие чего «белый» свет разлагается на цветные составляющие.
Исследование спектров. Спектральные приборы.
На дисперсии сложного излучения в трехгранной призме из прозрачного вещества (для видимого света - тяжелое стекло-флинт, для ультрафиолетового излучения - кварц и для инфракрасного - каменная соль или сильвин) основано устройство приборов для исследования спектра и измерения длины волн сложного излучения (спектроскопов и спектрографов).
 |
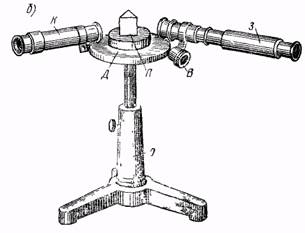 |
| Рис.4 Призменный спектроскоп. а - оптическая схема и ход лучей, б –внешний вид и компоненты прибора |
Простейший призменный спектроскоп (рис. 4, б) состоит из штатива О, на котором укреплен горизонтальный диск Д с делениями. В центре диска устанавливается призма П, по краям диска расположены две трубы: коллиматор К и зрительная 3, которая с помощью винта В может устанавливаться под необходимым углом. Коллиматор (рис. 4, а) имеет на конце щель, перед которой помещается источник света; линза О, образует пучок параллельных лучей, что необходимо для того, чтобы лучи, прошедшие через призму, состояли также из параллельных пучков. Эти пучки объективом О2 зрительной трубы фокусируются в его фокальной плоскости FF и образуют каждый изображение щели соответствующего цвета, которое называется спектральной линией. Совокупность этих линий образует исследуемый спектр, который в увеличенном виде наблюдается через окуляр Ок. Спектрограф (рис. 5: а -общий вид и б - схема устройства) - более сложный прибор, приспособленный для фотографирования спектров. Свет через щель Д и линзу Л1 направляется на дисперсионную призму П, пучки спектрально разложенного света фокусируются линзой Л2 на фотопластинке Ф.
 |
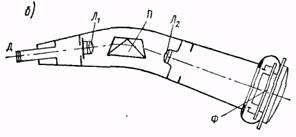 |
| Рис. 5 |
Пользуясь спектральным прибором, можно получить монохроматический свет необходимой длины волны. Для этого в фокальной плоскости второй линзы Л2 помещают щелевую диафрагму, с помощью которой и выделяют из спектра желаемую линию. Такой прибор называется монохроматором.
Классификация спектров.
Все спектры делятся на два основных класса: спектры испускания (или эмиссионные) и спектры поглощения. Каждый класс, в свою очередь, подразделяется на непрерывные (сплошные), полосатые и линейчатые спектры.
Спектры, состоящие из ярких линий или полос на темном фоне, называются спектрами испускания. Они возникают, когда вещество сильно нагревается или подвергается бомбардировке электронами. Спектры поглощения, состоящие из темных участков на ярком фоне, получаются, когда белый свет проходит сквозь полупрозрачную среду, которая поглощает некоторые частоты.

Рис.6. Спектр испускания железа Fe
 |
| Рис.7 Примеры оптических спектров. Спектры испускания: 1-сплошной, 2-натрия, 3-водорода, 4-гелия Спектры поглощения: 5солнечный, 6-натрия, 7-водорода, 8-гелия |
Линейчатый спектр является спектром, в котором появляются только определенные длины волн, или «линии». Полосатый спектр состоит из линий, сгруппированных в полосы. Спектры испускания и поглощения индивидуальны для каждого вещества, поэтому их применяют для идентификации веществ в науке спектроскопии. Спектры являются результатом переходов электронов между различными энергетическими уровнями в атомах или молекулах вещества, что приводит к испусканию или поглощению электромагнитного излучения.
Эмиссионные спектры (спектры испускания) возбуждаются для паров и газов путем электрического разряда, для жидких и твердых тел - путем нагревания до высокой температуры, например в бесцветном пламени газовой горелки. Для органических веществ, разрушающихся под действием высокой температуры, обычно исследуются абсорбционные спектры, или спектры поглощения. Спектром поглощения называется совокупность темных линий или полос, образующихся в сплошном спектре белого света при прохождении его сквозь данную прозрачную среду. Для получения спектра поглощения в спектральном приборе между источником белого света (например, электрической дугой и щелью коллиматора или между коллиматором и призмой) по метается исследуемое вещество, например плоскопараллельная кювета с исследуемым раствором.
Теория Бopa. Спектр атома водорода
В 1913 г. Н. Бор предложил теорию механизма излучения света атомами, учитывающую квантовую природу света. Теория основывается на двух постулатах:
1. Внутренняя энергия атома дискретна; она может принимать только определенные дозволенные значения (или уровни), характерные для данного атома. Состояния атома, соответствующие этим уровням энергии, являются стационарными: в таком состоянии атом не излучает электромагнитных волн, несмотря на происходящее в нем движение электронов.
2. При переходе атома из одного стационарного состояния в другое испускается (или поглощается) монохроматическое электромагнитное излучение, частота которого обусловлена энергией, равной разности энергетических уровней Е2 и E1, соответствующих этим состояниям:

где h - постоянная Планка.
| Таблица 1. Значения энергии на различных уровнях в атоме водорода | |
| Главное квантовое число | Энергия уровня |
| n = 1 | Е1 = -13,55 эВ(основной) |
| n = 2 | Е2 = -3,88 эВ |
| n = 3 | Е3 = -1,5 эВ |
| n = 4 | Е4 = -0,84 эВ |
| n = 5 | Е5 = -0,54 эВ |
| n = 6 | Е6 = -0,38 эВ |
Используя ядерную модель атома, Бор предложит считать, что стационарным состояниям, или дозволенным энергетическим уровням, атома соответствует движение электронов по орбитам определенного радиуса.
Исходя из условия квантования, Бор рассчитал энергетические уровни для атома водорода. В атоме электрон удерживается на орбите силой кулоновского притяжения к ядру, обусловливающей центростремительное ускорение.
Для первой, основной, орбиты радиус r1 = 0,53•10-8 см, что согласуется с расчетами на основании кинетической теории газов. Скорость движения электрона по стационарной орбите для основной орбиты атома водорода v1= 2,3•108 см/с. Таков порядок скорости движения электронов по орбите.
 |
 |
| Рис.8 Переходы электрона в атоме водорода: а –возбуждение и излучение 1 кванта с энергией ΔE=E3 - E1 б- возбуждение и излучение 2 квантов с энергиями E3-E2 и E2-E1 |
Полная энергия электрона Ев = Ек + Еп, причем потенциальная энергия зависит от радиуса орбиты. Энергетические уровни обратно пропорциональны квадрату квантового числа и их значения представлены в таблице1.
Поскольку с увеличением радиуса орбиты отрицательные значения энергии электрона убывают по абсолютной величине, можно считать, что энергетические уровни при этом повышаются.
Таким образом, по мере удаления от ядра энергетические уровни атома возрастают:
Е1 < E2 <E3 < …
С возрастанием числа n разность между каждыми двумя соседними уровнями по абсолютной величине уменьшается:
ΔE’> ΔE’’ > ΔE’’’ > …
где ΔE’=E2-E1; ΔE’’=E3–E2; ΔE’’’=E3–E2. Стационарный уровень с наименьшей энергией называется основным, он соответствуем состоянию атома, не подвергающегося никаким внешним воздействиям. Остальные стационарные уровни называются возбужденными. Возбуждение атома, т. е. переход электрона на орбиту большего радиуса, требует сообщения дополнительной энергии и, следовательно, происходит в результате каких-либо внешних воздействий: при соударении частиц в процессе интенсивного теплового движения, электрическом разряде в газах, поглощении электромагнитного излучения, в результате рекомбинации ионов в газе или электронов и дырок в полупроводнике, при действии на атом радиоактивного излучения и некоторых других воздействиях.
Возбужденное состояние атома неустойчиво, примерно через 10-8 с электрон возвращается на основную орбиту, при этом излучается один фотон с энергией hv, равной энергии, полученной при возбуждении (рис.8, а), и атом переходит в основное состояние. Электрон может возвращаться на основную орбиту не только единым переходом, но и через промежуточные уровни. В этом случае при переходе будут излучаться несколько фотонов с энергиями hv' и hv", равными разности энергий этих уровней (рис.8, б).
Теория Бора объяснила не только происхождение линейчатых спектров, но и структуру спектра излучения атомов водорода. В зависимости от энергии, полученной при возбуждении атома, электрон переходит на различные возбужденные уровни. При возвращении его на основной уровень (особенно если этот переход совершается ступенчато) излучаются кванты различной энергии. Поэтому в спектре излучения атома водорода должно быть значительное число линий, расположение которых соответствует энергетическим уровням атома и возможным переходам электрона.
Еще до создания теории Бора было установлено, что в спектра водорода имеются группы, или серии, линий, частоты которых находятся между собой в определенных соотношениях, например, серия Лаймана (в ультрафиолетовой части спектра), Бальмера (в видимой части спектра), Пашенна (в инфракрасной области) и др.

Рис.9. Спектральные серии атома водорода. а- переход электрона, б- энергетические уровни, в- расположение линий в спектре излучения (видимая область спектра см. рис 7).
Теория Бора объяснила происхождение этих серий (риc. 9). Энергия излучаемых -фотонов равна разности энергетических уровней Еп и Ет перехода электрона: hv = Еn - Еn0, откуда v = (Еn - En0)/h. Таким образом, по теории Бора, к серии Лаймана, например, относятся все переходы электронов с возбужденных уровней (n = 2, 3, 4,...) на основной (n0 = 1), к серии Бальмера - переходы с более высоких (n - 3, 4, 5,...) на первый возбужденный уровень (n0 = 2) и т. д.
Теория Бора получила подтверждение в спектральных закономерностях атома водорода. Однако попытка применить ее к спектрам более сложных атомов встретила значительные затруднения.
Молекулярные спектры
Если энергия, сообщенная атому, незначительна, то на возбужденные уровни в основном переходят валентные электроны. Частота излучения при этом соответствует оптической части спектра (видимое и близкие к нему части инфракрасного и ультрафиолетового излучений). У атомов с высоким порядковым номером более значительная энергия возбуждения обусловливает переходы электронов между уровнями, соответствующими внутренним слоям. Излучение при переходах электронов между этими уровнями имеет значительно более высокую частоту и относится к дальнему ультрафиолетовому и рентгеновскому.
Молекулы имеют более сложные спектры излучения (или поглощения), чем атомы того же вещества. При соединении атомов в молекулу изменяется конфигурация оболочки с валентными электронами, в твердых телах образуются энергетические зоны, в связи с чем число возможных переходов электронов и соответствующих им спектральных линии значительно возрастает.
Кроме уровней (Еe), связанных о переходами электронов, у молекул появляются энергетические уровни (Ем), обусловленные, во-первых, колебательным движением ядер атомов, образующих молекулу около положения равновесия (Екол), и, во-вторых, вращательным движением самой молекулы (Евр). Энергия этих видов движения также квантуется, т. е. имеет свои дозволенные (квантованные) энергетические уровни Таким образом, молекулярные спектры состоят из трех компонентов - электронного, колебательного и вращательного. Внешние воздействия усиливают интенсивность этих видов молекулярного движения, т. е. возбуждают молекулу, которая затем возвращается в основное состояние, излучая фотон с энергией, равной разности энергетических уровней перехода.
Все эти компоненты дают в спектре множество близко расположенных линий, которые в совокупности образуют полосатые (преимущественно у паров и газов) или сплошные (у твердых и жидких тел) спектры.
Как показывают теория и опыт, Евр <<Eкол <<Ее, поэтому молекулярные спектры занимают широкие диапазоны электромагнитного излучения, причем вращательная и колебательная составляющие относятся преимущественно к инфракрасному излучению, а электронная - к видимому и ультрафиолетовому.
Анализ молекулярных спектров, особенно в инфракрасной области широко используется при изучении строения молекул.
Вращательная составляющая молекулярных спектров может занимать также область коротких радиоволн. Исследование спектров излучения и поглощения в этом диапазоне называют радиоспектроскопией. Эти данные дополняют сведения о строении молекул, полученные с помощью оптической спектроскопии.
Наиболее распространенным методом радиоспектроскопии является метод электронного парамагнитного резонанса (ЭПР). В случае непарамагнитных тел для аналогичных целей используется явление ядерного магнитного резонанса (ЯМР).
Возбужденное состояние атома или молекулы может разрешаться не только путем излучения фотона. Оно может вызвать фотохимическую реакцию, перестройку структуры сложной молекулы, а полученная при возбуждении энергия может быть передана другим частицам в процессе теплового движения. Эти явления носят название безызлучательных энергетических переходов.
Рассеяние и поглощение света. Закон Бугера-Ламберта-Бера.
При прохождении через вещественную среду световая волна постепенно ослабляется. Это происходит в связи с рассеянием и поглощением света.
Рассеяние света происходит в неоднородных средах при условии, что размеры неоднородностей соизмеримы с длиной волны света. Если неоднородность среды образована посторонними частицами, беспорядочно распределенными в массе среды, то рассеяние света называют явлением Тиндаля, а среды - мутными, например мелкий туман, дым, различные взвеси и эмульсии и т. п. Это явление можно наблюдать, например, когда узкий пучок солнечных лучей проходит сквозь запыленную атмосферу: свет рассеивается на пылинках н весь пучок становится видимым при наблюдении с любой стороны.
Длина волны света при рассеянии не изменяется, а интенсивность рассеянного света тем выше, чем меньше размеры этих неоднородностей сравнительно с длиной волны. Интенсивность рассеяния зависит также от длины волны света: короткие волны рассеиваются значительно сильнее, чем длинные. Можно считать, что интенсивность рассеянного света обратно пропорциональна примерно второй степени длины волны для более крупных и третьей степени - для более мелких частиц. Поэтому, например, мелкодисперсный туман имеет синий цвет, а состоящий из более крупных капелек - белый
Рассеяние света может происходить также и в однородной среде на мгновенных неоднородностях (флуктуациях) плотности вещества, образующихся в связи с тепловым движением атомов и молекул, например в чистом газе в процессе теплового движения молекулы в различные моменты сближаются в одних точках объема газа и разреживаются в других. Этот вид рассеяния называется молекулярным рассеянием. Интенсивность рассеянного света обратно пропорциональна четвертой степени длины волны падающего света (закон Рэлея). В связи с этим, например, свечение неба наблюдается сине-голубым, а прямое солнечное излучение приобретает желто-красный оттенок, особенно при восходе и заходе Солнца, когда это излучение проходит более длинный путь в атмосфере.
При рассеянии света в однородных жидкостях и кристаллах в рассеянном свете кроме падающей волны частотой ω0 появляются волны с частотой ωм, отличающейся от нее на определенную величину Δω, характерную для молекулярной структуры данного вещества. Этот вид молекулярного рассеяния называется комбинационным рассеянием света и имеет значение для изучения структуры вещества.
 |
 |
| Рис. 10 |
При рассеянии света энергия сохраняет свою электромагнитную природу. При поглощении света она переходит в другие виды внутренней энергии, при этом в веществе могут происходить различные явления: повышение интенсивности теплового движения (тепловой эффект), возбуждение и ионизация атомов и молекул, активация молекул (фотохимический эффект) и т. п.
Закон поглощения в однородной среде для параллельного пучка монохроматического света был установлен Н. Бугером: в каждом последующем слое среды одинаковой толщины поглощается одинаковая часть потока энергии падающей на него световой волны, независимо от его абсолютной величины.
Определим на основании этого закона интенсивность Id световой волны, прошедшей слой среды толщиной d, если падающая на поверхность среды волна имеет интенсивность I0. Для этого выделим на расстоянии х от поверхности слой среды толщиной dx (рис. 10, а). Убывание dIx интенсивности Ix волны вследствие поглощения света этим слоем по закону Бугера пропорционально величине Ix и толщине слоя dx:

где α - коэффициент пропорциональности. Уравнению можно придать вид dIx/Ix = - α dx.
Решая это уравнение, получим для слоя толщиной х = d
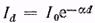
График изменения интенсивности света Ix в зависимости от толщины слоя среды, который проходит свет, показан на рис. 10, б (экспоненциальная кривая).
Коэффициент пропорциональности α называется показателем поглощения и характеризует поглощательную способность вещества.
Он зависит от его природы и состояния, а также от частоты (длины волны λ0) света. У металлов показатель поглощения весьма высок (порядка 103-108 см-1) Это объясняется наличием в металлах свободных электронов, вынужденные колебания которых легко возбуждаются и имеют значительную амплитуду. Падающая на поверхность металла световая волна быстро расходует свою энергию и потому проникает на самую малую глубину.
У диэлектриков показатель поглощения в общем невелик (порядка 10-3 – 10-5 см-1), однако у них наблюдается селективное поглощение света в определенных интервалах длин волны, в которых показатель поглощения резко возрастает. Это связано с тем, что в диэлектриках нет свободных электронов и значительное поглощение света происходит только при резонансных колебаниях, т. е. при частотах световой волны, близких к собственным (или кратным им) частотам колебаний электронов диэлектрика. Это явление объясняет, например, линейчатые спектры поглощения газов в атомарном состоянии.
 |
| Рис.11 |
Примерный характер зависимости показателя поглощения от длины волны к показан на рис. 11. На рис. 11, а - график 1 для тел, равномерно поглощающих свет любой длины волны (черные и серые тела), 2 - для тел, поглощающих свет любых длин волн начиная с некоторой граничной λгр, 3 - для тел, имеющих широкую полосу поглощения в пределах длин волн от λ1 до λ2. На рис. 11 б - для тел с селективным (резонансным) поглощением при определенных длинах волн λ1, λ2 и λ3.
Постепенное убывание интенсивности света при прохождении через среду вследствие рассеяния также подчиняется закону Бугера, формула которого с учетом как поглощения, так и рассеяния принимает вид

 |
| Рис. 12. Ослабление света от интенсивности I0 до Id при прохождении через слой вещества (раствора) толщиной d, с концентрацией с и коэффициентом поглощения (экстинкции) α. |
где σ - показатель ослабления света вследствие рассеяния.
Исследуя поглощение монохроматического света растворами окрашенных веществ (при условии, что растворитель не поглощает света данной длины волны и раствор имеет невысокую концентрацию), А. Бер показал, что оно подчиняется закону Бугера, причем показатель поглощения α прямо пропорционален концентрации вещества в растворе (закон Бера): α = χС, где χ - показатель поглощения для раствора единичной концентрации. Тогда формула закона Бугера-Ламберта-Бера примет вид
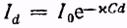
или в системе десятичных логарифмов  , где
, где 
Отношение Id/I0 = τ называют коэффициентом пропускания или прозрачностью раствора, а величину D = lg (Id/I0) = -lg τ - оптической плотностью. В соответствии с приведенной выше формулой оптическая плотность раствора D = χ'Cd.
 |
| Рис.13 |
На законе Бугера-Бера основан метод определения концентрации растворов путем сравнения толщин d1 и d2 слоев двух растворов одного и того же вещества, исследуемого с концентрацией С1 и стандартного С2, в которых имеет место одинаковое поглощение света. В приборе, называемом концентрационным колориметром, свет от одного и того же источника проходит через слои d1 и d2 растворов; изменением толщины слоев уравнивается яркость двух половин поля зрения, освещенного светом, прошедшим через эти растворы (рис. 13). При этом уравниваются и оптические плотности растворов: D1 = D2, или C1d1 = C2d2, откуда C1/C2 = d1/d2, т. е. концентрации С1 и С2 обратно пропорциональны толщинам слоев d1 и d2.
Аналогичный метод определения концентрации вещества в коллоидном растворе называется нефелометрией. При этом сравниваются интенсивности света, рассеянного частицами в стандартном и исследуемом растворах: при относительно невысоких концентрациях они пропорциональны концентрации взвешенных частиц и высоте столба раствора. Растворы освещаются боковым светом.
Спектры (как эмиссионный, так и абсорбционный) тесно связаны со строением атомов и молекул вещества. Поэтому по их характеру можно судить о природе и составе как простых, так и сложных веществ. Метод качественного или количественного определения состава вещества по его спектру называется спектральным анализом Основное преимущество его в том, что для анализа требуется исключительно малое количество вещества Путем спектрального анализа может быть обнаружено присутствие вещества в количестве до 10-8 г. С помощью спектрального анализа, например, было установлено, что живые организмы содержат в крайне незначительных количествах многие металлы - кобальт, хром, титан и др. Спектральный анализ позволяет установить следы крови (судебная медицина), микропримеси металлов в консервированных продуктах (пищевая гигиена и т. п.).
Абсорбционная спектрофотометрия.
Для исследования молекулярного состава органических веществ применяют абсорбционную спектроскопию, обычно при этом исследуемое вещество растворяют в воде, которая сама не дает спектра поглощения в области видимого света. С помощью абсорбционной спектроскопии, например, был установлен молекулярный состав многих витаминов, гормонов и т. п.
 |
| Рис.14. Спектры поглощения гемоглобина и его соединений в видимом свете: 1 — гемоглобин; 2 — оксигемоглобин; 3 — карбоксигемоглобин; 4 — метгемоглобин: |
Применение абсорбционной спектрофотометрии в видимой и ультрафиолетовой областях спектра для методик количественного определения основано на том факте, что поглощаемость вещества обычно является константой, независимой от интенсивности падающего излучения, длины кюветы и концентрации, вследствие чего концентрация может быть определена фотометрически. Отклонения от приведенных выше величин могут быть обусловлены физическими, химическими или инструментальными переменными. Отклонения вследствие инструментальной ошибки могут быть вызваны влиянием ширины щели, рассеянием света или полихроматическим излучением. Очевидные ошибки могут также появиться в результате изменения концентрации растворенных молекул вследствие ассоциации между молекулами растворенного вещества, между молекулами растворенного вещества и растворителя, а также вследствие диссоциации или ионизации
Свойство атомов и молекул поглощать свет с определенной длиной волны, характерной для данного вещества, широко используется в медицине и фармации для качественных и количественных исследований. Измерение спектров поглощения позволяет судить о химическом составе вещества и его состоянии в биологических структурах. Для регистрации спектров поглощения используются приборы спектрофотометры.
Спектр поглощения — часто выражаемое графически отношение поглощения или любой функции поглощения к длине волны или любой функции длины волны (см. рис.7, 11). Спектры поглощения веществ определяются разностью энергий между энергетическими уровнями молекул, составляющими вещество, а также вероятностями перехода между ними. Разность энергий определяет длину волны, на которой происходит поглощение света, вероятность перехода - коэффициент поглощения вещества. Для биологически важных молекул характерны широкие полосы поглощения, обусловленные электронными, колебательными и вращательными уровнями. Молекулярные группы, поглощающие свет, называют хромофорами.
Стандартный диапазон измерений в абсорбционной спектрофотометрии: 180-1100 нм. Он включает в себя три области спектра: ближнюю ультрафиолетовую область (УФ) -180-380 нм; видимую (ВИД) - 380-760 нм и ближнюю инфракрасную (ИК) - 760-1100 нм.
Нуклеиновые кислоты поглощают только в УФ области (180-220 и 240-280 нм). Их хромофорами являются, в основном, пуриновые и пиримидиновые основания.
Белки имеют три типа хромофорных групп: собственно пептидные группы, боковые группы аминокислотных остатков и простетические группы. Первые две поглощают в УФ области и не поглощают в видимой области. Пептидные группы -CO-NH- поглощают в районе 190 нм. Боковые группы трех ароматических кислот - триптофана, тирозина и фенилаланина - также поглощают на этих длинах волн, причем значительно сильнее, чем пептидные группы. Кроме того они имеют полосу поглощения в диапазоне 260-280 нм.
Простетические группы (гем в гемоглобине и др. хромофоры) поглощают в УФ и в видимой области. Именно они придают белку цвет (например, красный цвет гемоглобину). Спектр поглощения гемоглобина (рис. 15) имеет характерные максимумы в видимой области (~400 нм и 525-580 нм), а также в ближней ИК-области (900 нм). Спектры поглощения гемоглобина, связавшего кислород (оксигемоглобин) – красная линия и свободного гемоглобина (деоксигемоглобин) – синяя иния отличаются. Поэтому с помощью спектров поглощения можно измерить содержание кислорода в крови человека.

Рис.15. Спектры поглощения гемоглобина и оксигемоглобина в оптической области излучения
Примеры использования спектрофотометрии в биологии, медицине и фармации.
· Измерение концентрации белков и нуклеиновых кислот.
· Оценка кровоснабжения тканей на основе измерений степени оксигенации гемоглобина.
· Измерение рН среды с помощью красителей, изменяющих спектр поглощения с изменением рН.
· Определение концентрации различных лекарственных средств, имеющих характерные спектры поглощения (рутин, берберин).
· Отслеживание динамики размножения микроорганизмов по изменению оптической плотности среды, в которой они находятся.
Принципиальная схема спектрофотометра.
Спектрофотометр состоит из следующих основных блоков (рис.16): источника света (И), монохроматора (М), измерительной кюветы (К1) и кюветы сравнения (К2), фотоприемника (Ф) и регистратора (индикатора) (Р).
 |
| Рис.16. Принципиальная схема спектрофотометра |
Источник (И) испускает свет, монохроматор (М) выделяет из него нужный участок спектра. Этот свет далее проходит либо через измерительную кювету (К1), в которую, помещают исследуемый раствор, либо через кювету сравнения (К2), заполненную растворителем (в этом случае кювету К2 помещают вместо кюветы К1). Свет, прошедший через кювету, регистрируют фотоприемником (Ф), и его интенсивность либо записывают каким-либо регистратором, либо отображают на индикаторе. В качестве индикатора можно использовать стрелочный прибор. Две кюветы используют для того, чтобы исключить паразитные эффекты, связанные с поглощением света в растворителе и его отражениями от стенок кюветы.
 2017-11-01
2017-11-01 6167
6167