Метод кислотно-основного титрования основан на реакциях кислотно-основного взаимодействия, которое в общем виде можно представить как
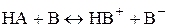 ,
,
где НА – кислота; В – основание; НВ+ - сопряженная кислота; В– – сопряженное основание.
В результате взаимодействия растворов сильных кислот и оснований раствор становится нейтральным, поэтому метод кислотно-основного титрования иногда называют методом нейтрализации. Метод кислотно-основного титрования в водной среде позволяет количественно определять многие вещества, при этом прямой метод можно использовать для титрования кислот или оснований, константы диссоциации которых не менее 10–7.
В методе кислотно-основного титрования различают алкалиметрию (титрант – стандартный раствор основания) и ацидиметрию (титрант – стандартный раствор кислоты). Типичны следующие варианты титрования: 1) титрование сильной кислоты сильным основанием; 2) титрование сильного основания сильной кислотой; 3) титрование слабой кислоты сильным основанием; 4) титрование слабого основания сильной кислотой; 5) титрование многоосновных кислот или многокислотных оснований; 6) титрование смесей кислот или смесей оснований разной силы.
В данной лабораторной работе используем титрование сильного основания сильной кислотой в соответствие с уравнением реакциии
2NaOH + H2SO4 = Na2SO4 + 2Н2О.
Реактивы и оборудование. Титрант – стандартный раствор H2SO4 c концентрацией C[1/2(H2SO4)] = 0,10 н; коническая колба для титрования объемом 250 см3; пипетка на 10,00 см3; бюретка объемом 25 см3; кислотно-основной индикатор метиловый оранжевый 1% раствор.
Выполнение работы. Определяют концентрацию раствора гидроксида натрия, приготовленного в опыте 1. Техника отбора проб и титрования описана в разделе 3. Готовят бюретку для титрования и заполняют ее стандартным раствором кислоты. Раствор NaOH из мерной колбы переливают в чистый сухой химический стакан, пипеткой объемом 10,00 см3 отбирают аликвотный объем раствора гидроксида натрия и переносят его в коническую колбу для титрования. Стенки колбы обмывают небольшим количеством дистиллированной воды, добавляют 2 капли индикатора метилового оранжевого и начинают титрование. Последние порции кислоты приливать по каплям. Титрование останавливают в тот момент, когда произойдет резкий переход окраски от желтой к оранжево-красной. Записывают объем раствора кислоты, пошедший на титрование. Повторяют титрование еще 3 раза. Перед каждым титрованием коническую колбу моют и ополаскивают дистиллированной водой.
Запись данных опыта и расчеты. Данные записать по приведенной ниже форме.
Объем мерной колбы V = 100,00 см3
Концентрация титранта Cн[1/2(H2SO4)] = 0,10 н
Индикатор – метиловый оранжевый
| № п/п | Объем аликвоты V(NaOH), см3 | Эквивалентный объем титранта V(H2SO4), см3 |
По результатам титрования найти средний объем титранта 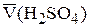 =
=
Рассчитать эквивалентную концентрацию NaOH. На основании закона эквивалентов
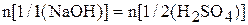
рассчитывают эквивалентную концентрацию гидроксида натрия
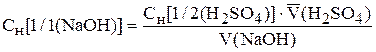
 2015-05-26
2015-05-26 10136
10136








