Алгоритм 1. Подбор коэффициентов в схемах окислительно-восстановительных реакций, протекающих в кислой среде
1. На основании схемы окислительно-восстановительной реакции составьте полное и краткое ионные уравнения (без учета коэффициентов в схеме, так как они еще не подобраны):
KMnO4 + Na2SO3 + H2SO4 → K2SO4 + MnSO4 + Na2SO4 + H2O.
K+ + MnO  + 2Na+ + 2SO
+ 2Na+ + 2SO  + 2H+ + SO
+ 2H+ + SO  → 2K+ + SO
→ 2K+ + SO  + Mn2+ + SO
+ Mn2+ + SO  +
+
+ 2Na+ + SO  + H2O.
+ H2O.
При составлении краткого ионного уравнения будьте внимательны.
Каждой частице в левой части краткого ионного уравнения должна соответствовать частица в правой части краткого ионного уравнения, состав или заряд которой должен отличаться от частицы, находящейся в левой части краткого ионного уравнения:
MnO  + SO
+ SO  + 2H+ → Mn2+ + SO
+ 2H+ → Mn2+ + SO  + H2O.
+ H2O.
2. На основании краткого ионного уравнения составьте ионно-электронные уравнения. Для этого выпишите попарно частицы, изменившие свой состав или заряд в ходе реакции, кроме ионов Н+, ОН− и молекул воды:
MnO  → Mn2+
→ Mn2+
SO  → SO
→ SO 
После этого выполните следующие операции: если в левой части схемы у частицы есть избыток атомов кислорода, по сравнению с частицей в правой части схемы, то избыток атомов кислорода нужно связать средой – ионами водорода – с образованием молекул воды; если в левой части схемы у частицы недостаток атомов кислорода по сравнению с частицей в правой части схемы, то недостаток атомов кислорода нужно взять из молекул воды с образованием ионов Н+:
MnO  + H+ → Mn2+ + H2O,
+ H+ → Mn2+ + H2O,
SO  + H2O → SO
+ H2O → SO  + H+.
+ H+.
Определите суммарный заряд каждой части схемы, помня, что молекула любого вещества имеет заряд равный нулю:

 MnO
MnO  + 8H+ → Mn2+ + 4H2O0,
+ 8H+ → Mn2+ + 4H2O0,
7+ 2+

 SO
SO  + H2O0 → SO
+ H2O0 → SO  + 2H+.
+ 2H+.
2- 0
Определите, какая из систем отдает или принимает электроны по следующим правилам:
если заряд системы в ходе реакции понижается – система принимает электроны;
если заряд системы в ходе реакции повышается, система отдает электроны:

 MnO
MnO  + 8H+ + 5ē → Mn2+ + 4H2O
+ 8H+ + 5ē → Mn2+ + 4H2O
7+ 2+

 SO
SO  + H2O – 2ē → SO
+ H2O – 2ē → SO  + 2H+
+ 2H+
2− 0
В любой окислительно-восстановительной реакции происходит перераспределение электронов между взаимодействующими частицами – одни частицы отдают электроны, а другие принимают столько же электронов. Если в ионно-электронных уравнениях число отданных электронов не равно числу принятых электронов, то для этих чисел электронов найдите наименьшее общее кратное, а по нему – коэффициенты, разделив наименьшее общее кратное на число отданных или принятых электронов:
коэффициенты наименьшее общее кратное

 2 MnO
2 MnO  + 8H+ + 5ē → Mn2+ + 4H2O 10
+ 8H+ + 5ē → Mn2+ + 4H2O 10
5 SO  + H2O – 2ē → SO
+ H2O – 2ē → SO  + 2H+
+ 2H+
Составьте суммарное уравнение, суммируя левую часть первой схемы с левой частью второй схемы, расставляя коэффициенты, а затем суммируйте правую часть первой схемы с правой частью второй схемы, расставляя коэффициенты:
 2 MnO
2 MnO  + 8H+ + 5ē → Mn2+ + 4H2O,
+ 8H+ + 5ē → Mn2+ + 4H2O,
 5 SO
5 SO  + H2O – 2ē → SO
+ H2O – 2ē → SO  + 2H+
+ 2H+
Σ: 2MnO  + 16H+ + 5SO
+ 16H+ + 5SO  + 5Н2О → 2Mn2+ + 8H2O + 5SO
+ 5Н2О → 2Mn2+ + 8H2O + 5SO  + 10H+.
+ 10H+.
Проверьте, есть ли в левой и правой части суммарного уравнения одинаковые частицы. Если они есть, то их нужно исключить. Исключите из суммарного уравнения по 10 ионов Н+ и по 5 молекул воды. Суммарное уравнение приобретет следующий вид:
Σ: 2MnO  + 6H+ + 5SO
+ 6H+ + 5SO  → 2Mn2+ + 3H2O + 5SO
→ 2Mn2+ + 3H2O + 5SO  .
.
3. Расставьте полученные в суммарном уравнении коэффициенты в схему окислительно-восстановительной реакции, а затем подберите коэффициенты для атомов всех элементов, кроме атома кислорода:
2KMnO4 + 5Na2SO3 + 3H2SO4 → 1K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O.
Если для каждого соединения в схеме окислительно-восстановительной реакции подобраны коэффициенты, то проверьте правильность подбора коэффициентов. Для этого подсчитайте число атомов кислорода в левой и правой части схемы. Если оно в обеих частях схемы одинаково, то коэффициенты подобраны правильно. Запишите эти числа в рамочку. В нашем случае атомов кислорода, в каждой части уравнения реакции 35: 35=35
В любой окислительно-восстановительной реакции участвуют окислитель и восстановитель, протекают процессы окисления и восстановления.
Окислителем называется частица, принимающая электроны. Она в ходе реакции превращаются в восстановитель.
Восстановителем называется частица, отдающая электроны. Она в ходе реакции превращается в окислитель. В реакцию вступают сильные окислители и восстановители, образуются слабые окислители и восстановители.
Процессом окисления называется процесс отдачи электронов. Восстановитель отдает электроны – окисляется.
Процессом восстановления называется процесс принятия электронов. Окислитель принимает электроны – восстанавливается. В схемах электронных уравнений укажите окислители и восстановители, процессы окисления и восстановления:
MnO  + 8H+ + 5ē → Mn2+ + 4H2O – процесс восстановления
+ 8H+ + 5ē → Mn2+ + 4H2O – процесс восстановления
окислитель1 восстановитель1
SO  + H2O − 2ē → SO
+ H2O − 2ē → SO  + 2H+ − процесс окисления
+ 2H+ − процесс окисления
восстановитель2 окислитель2
В уравнении окислительно-восстановительной реакции укажите окислитель, восстановитель, вещество, обуславливающее среду раствора:
2KMnO4 + 5Na2SO3 + 3H2SO4 → K2SO4 + 2MnSO4 + 5Na2SO4 + 3H2O
окислитель восстановитель вещество, среда
обуславливающее нейтральная
среду раствора,
среда кислая
В результате протекания окислительно-восстановительной реакции изменяется среда раствора – была кислой, стала нейтральной.
Алгоритм 2. Подбор коэффициентов в схеме окислительно-восстановительной реакции, протекающей в нейтральной среде
1. Составьте полное и краткое ионные уравнения на основании схемы окислительно-восстановительной реакции, учитывая, что коэффициенты еще не подобраны:
KMnO4 + Na2SO3 + H2O → KOH + MnO2 + Na2SO4,
K+ + MnO  + 2Na+ + SO
+ 2Na+ + SO  + H2O → K+ + OH− + MnO2 + 2Na+ + SO
+ H2O → K+ + OH− + MnO2 + 2Na+ + SO  ,
,
MnO  + SO
+ SO  + H2O → MnO2 + SO
+ H2O → MnO2 + SO  + OH−.
+ OH−.
2. Составьте ионно-электронные уравнения аналогично указаниям в алгоритме 1.
MnO  → MnO2,
→ MnO2,
SO  → SO
→ SO 
Избыток кислорода в ионе MnO  свяжите, добавив молекулы воды, с образованием ионов OH−, а недостаток атомов кислорода в ионе SO
свяжите, добавив молекулы воды, с образованием ионов OH−, а недостаток атомов кислорода в ионе SO  возьмите из молекул воды с образованием ионов Н+:
возьмите из молекул воды с образованием ионов Н+:
MnO  + H2O → MnO2 + OH−,
+ H2O → MnO2 + OH−,
SO  + H2O → SO
+ H2O → SO  + OH−.
+ OH−.
Подберите коэффициенты для атомов всех элементов в схемах, определите суммарные заряды частиц в левой и правой частях схем, укажите число отданных и принятых электронов. Далее выполните аналогично указаниям пункта 2 алгоритма 1:



 2 MnO
2 MnO  + 2H2O + 3ē → MnO2 + 4OH−,
+ 2H2O + 3ē → MnO2 + 4OH−,
1− 4− 6

 3 SO
3 SO  + H2O − 2ē → SO
+ H2O − 2ē → SO  + 2H+
+ 2H+
2− 0
При составлении суммарного уравнения реакции ионы Н+ и ОН− в правой части схемы напишите рядом, проведите реакцию нейтрализации (взаимодействие ионов Н+ с ОН−) с образованием молекул воды:
 2 MnO
2 MnO  + 2H2O + 3ē → MnO2 + 4OH−,
+ 2H2O + 3ē → MnO2 + 4OH−,
 3 SO
3 SO  + H2O − 2ē → SO
+ H2O − 2ē → SO  + 2H+,
+ 2H+,
 Σ: 2MnO
Σ: 2MnO  + 3SO
+ 3SO  + 7H2O → 2MnO2 + 3SO
+ 7H2O → 2MnO2 + 3SO  + 8OH− + 6H+
+ 8OH− + 6H+
6H2O + 2OH−
Исключите одинаковые частицы из левой и правой частей суммарного уравнения реакции – по 6 молекул H2O из обеих частей схемы:
Σ: 2MnO  + 3SO
+ 3SO  + H2O → 2MnO2 + 3SO
+ H2O → 2MnO2 + 3SO  + 2OH−
+ 2OH−
3. Далее выполните все операции так, как описано в п.3 алгоритма 1:
2KMnO4 + 3Na2SO3 + 1H2O → 2MnO2 + 3Na2SO4 + 2KOH
окислитель восстановитель вещество среда
определяющее щелочная
среду раствора,
среда нейтральная
Среда раствора была нейтральной, стала щелочной. Атомов кислорода: 18=18
MnO  + 2H2O + 3ē → MnO2 + 4OH− − процесс восстановления
+ 2H2O + 3ē → MnO2 + 4OH− − процесс восстановления
окислитель1 восстановитель1
SO  + H2O – 2ē → SO
+ H2O – 2ē → SO  + 2H+ - процесс окисления
+ 2H+ - процесс окисления
восстановитель2 окислитель2
Алгоритм 3. Подбор коэффициентов в схемах окислительно-восстановительных реакций, протекающих в щелочной среде
1. Выполните аналогично пункту 1 в алгоритмах 1,2:
Fe2O3 + KNO3 + KOH → K2FeO4 + KNO2 + H2O,
Fe2O3 + K+ + NO 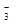 + K+ + OH− → 2K+ + FeO
+ K+ + OH− → 2K+ + FeO  + K+ + NO
+ K+ + NO  + H2O,
+ H2O,
Fe2O3 + NO 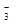 + OH− → FeO
+ OH− → FeO  + NO
+ NO  + H2O.
+ H2O.
2. Составьте ионно-электронные уравнения аналогично пункту 2 алгоритмов 1,2:
Fe2O3 → 2FeO 
NO 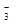 → NO
→ NO 
Недостаток атомов кислорода в частице возьмите из ионов ОН− с образованием молекул Н2О, а избыток атомов кислорода в частице свяжите молекулами Н2О с образованиями ионов ОН− (правило креста):


 1 Fe2O3 + 10OH− − 6ē → 2FeO
1 Fe2O3 + 10OH− − 6ē → 2FeO  + 5H2O
+ 5H2O
10− 4− 6

 3 NO
3 NO 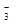 + H2O + 2ē → NO
+ H2O + 2ē → NO  + 2ОH−
+ 2ОH−
 1− 3−
1− 3−
Σ: Fe2O3 + 10OH− + 3NO 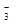 + 3H2O → 2FeO
+ 3H2O → 2FeO  + 5H2O + NO
+ 5H2O + NO  + 6ОH−.
+ 6ОH−.
Исключите из каждой части суммарного уравнения по 3 молекулы Н2О и 6 ионов ОН−:
Σ: Fe2O3 + 4OH− + 3NO 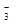 → 2FeO
→ 2FeO  + 2H2O + 3NO
+ 2H2O + 3NO 
Расставьте коэффициенты в схему окислительно-восстановительной реакции, подберите коэффициенты, проверьте правильность подбора коэффициентов:
Fe2O3 + 3KNO3 + 4KOH → 2K2FeO4 + 3KNO2 + 2H2O
восста- окислитель вещество, среда
новитель обуславливающее нейтральная
среду раствора,
среда щелочная
Среда раствора была щелочной, стала нейтральной. Атомов кислорода: 16=16
Fe2O3 + 10OH− − 6ē → 2FeO  + 5H2O – процесс окисления
+ 5H2O – процесс окисления
восстановитель 1 окислитель 1
NO 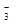 + H2O + 2ē → NO
+ H2O + 2ē → NO  + 2OH− − процесс восстановления
+ 2OH− − процесс восстановления
окислитель 2 восстановитель 2
В зависимости от среды раствора в окислителоно-восстановительной реакции могут образоваться различные продукты восстановления окислителя. Запомните продукты восстановления KMnO4 в зависимости от среды раствора:

 среда кислая MnSO4
среда кислая MnSO4

 KMnO4 среда нейтральная MnO2
KMnO4 среда нейтральная MnO2

 среда щелочная K2MnO4 (сильнощелочная), MnO2 (слабощелочная)
среда щелочная K2MnO4 (сильнощелочная), MnO2 (слабощелочная)
Рассматривая окислительно-восстановительные реакции нужно помнить, что ряд из них протекает при термическом разложении веществ (чаще всего – солей):
(N-3H4)2Cr2+6O7 → N20 + Cr2+3 O3 + 4H2O,
2KMn+7O4-2 → K2Mn+6O4 + Mn+4O2 + O20,
N-3H4N+3O2 → N20 + H2O.
Продукты термолиза солей азотной кислоты зависят от положения солеобразующего металла в ряду стандартных электродных потенциалов (Приложение В):

 Левее Mg: MNO2 + O2
Левее Mg: MNO2 + O2
 MNO3 Mg – Cu: MO + NO2 + O2
MNO3 Mg – Cu: MO + NO2 + O2
 Правее Сu: M + NO2 + O2.
Правее Сu: M + NO2 + O2.
При взаимодействии солей с кислотами руководствуйтесь рядом активности кислот (Приложение Г).
При взаимодействии Fe, Cr с сильными окислителями – образуются соединения Fe3+, Cr3+, а со слабыми окислителями – образуются Fe2+, Cr2+.
Соединения Fe(OH), Mn(OH)2 легко окисляются в момент образования:
4Fe(OH)2 + О2 +2Н2О → 4Fe(OH)3.
 2017-11-01
2017-11-01 5060
5060








