Одним из наиболее важных вопросов химии является вопрос химической связи, требующий объяснения причин и выявления закономерностей образования связей между атомами, ионами, молекулами на основе теории строения атома и Периодического закона Д.И. Менделеева, а также характеристики этих связей посредством интерпретации физических и химических свойств веществ.
Образование из атомов молекул, молекулярных ионов, ионов, кристаллических, аморфных и других веществ сопровождается уменьшением энергии по сравнению с невзаимодействующими атомами. При этом минимальной энергии соответствует определенное расположение атомов друг относительно друга, которому отвечает существенное перераспределение электронной плотности. Силы, удерживающие атомы в новых образованиях, получили обобщенное название «химическая связь». Важнейшими видами химической связи являются: ионная, ковалентная, металлическая, водородная, межмолекулярная.
При характеристике химической связи обычно пользуются такими понятиями, как «валентность», «степень окисления» и «кратность связи».
Валентность – способность атома химического элемента к образованию связи с другими атомами. За величину валентности принимают для ионных соединений количество отданных или принятых электронов. Для ковалентных соединений валентность равна числу обобществленных электронных пар.
Степень окисления – это условный заряд, который был бы на атоме в том случае, когда все полярные ковалентные связи были бы ионными.
Кратность связи между данными атомами равна числу их обобществленных электронных пар. Различают связи различной кратности между одними и теми же атомами. Химическая связь обычно изображается черточками, соединяющими взаимодействующие атомы; каждая черта эквивалентна обобщенной паре электронов.

F2 O2 N2
В зависимости от способа перераспределения электронов выделяют связи ковалентные, ионные и металлические. По наличию или отсутствию поляризации ковалентные связи делят: на полярные – между атомами разных элементов, и неполярные – между атомами одного элемента. По способу образования ковалентные связи разделяют на обычные, донорно-акцепторные и дативные.
Согласно электронной теории валентности, химическая связь возникает за счет перераспределения электронов валентных орбиталей, в результате чего возникает устойчивая электронная конфигурация благородного газа (октет) за счет образования ионов (В. Коссель) или образования общих электронных пар (Г. Льюис). Квантово - механические теории (теория валентных связей и метод молекулярных орбиталей) основаны на представлениях о волновой функции ψ, описывающей состояние электронов в молекуле, на основе приближенных решений уравнения Шредингера. Впервые подобный приближенный расчет был проведен В. Гайтлером и Ф. Лондоном для молекулы водорода.
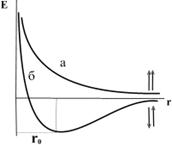
Энергия системы, состоящей из двух атомов водорода а - спины параллельны; б -спины антипараллельны; E - энергия системы, r0 - межъядерное расстояние в молекуле
В результате были получены уравнения, позволяющие найти зависимость потенциальной энергии системы Е, состоящей из двух атомов водорода, от расстояния r между ядрами этих атомов. При этом оказалось, что результаты расчета зависят от того, одинаковы или противоположны по знаку спины взаимодействующих электронов. При совпадающем наравлении спинов (кривая а) сближение атомов приводит к непрерывному возрастанию энергии системы. В этом случае для сближения атомов требуется затраты энергии, так что такой процесс оказывается энергетически невыгодным и химическая связь между атомами не возникает.
При противоположно направленных спинах (кривя б) сближение атомов до некоторого расстояния r0 сопровождается уменьшением энергии системы. При r = r0 система обладает наименьшей потенциальной энергией, т.е. находится в наиболее устойчивом состоянии; дальнейшее сближение атомов вновь приводит к возрастанию энергии. Но это и означает, что в случае противоположно направленных спинов атомных электронов образуется молекула Н2 – устойчивая система из двух атомов водорода, находящихся на определенном расстоянии друг от друга.
Химическая связь характеризуется энергией и длиной. Мерой прочности связи служит энергия, затрачиваемая на разрушение связи, или выигрыш в энергии при образовании соединения из отдельных атомов ( E св). Энергия химических связей - это энергия, которую необходимо затратить для разрыва химических связей. При этом из молекулы образуются атомы, радикалы, ионы или возбужденные молекулы.
Например:
H2  H
H + H
+ H , Есв = 432 кДж/моль,
, Есв = 432 кДж/моль,
H2O  H
H + OH
+ OH Есв = 461 кДж/моль,
Есв = 461 кДж/моль,
NaCl(тв)  Na+(г) + Cl-(г) Есв = 788,3 кДж/моль,
Na+(г) + Cl-(г) Есв = 788,3 кДж/моль,
C2H6  ?H3 +?H3, Есв = 356 кДж/моль.
?H3 +?H3, Есв = 356 кДж/моль.
Энергия связи, как видно, зависит от продуктов, которые получаются в результате ее разрыва. На основании таких данных введено представление об ординарных (одиночных), двойных, тройных и, вообще, кратных связях.
Длина связи (нм,?) - расстояние между ядрами соседних атомов в молекуле. Ее можно определить экспериментально современными физическими методами (электронографически, рентгенографически, методом инфракрасной интроскопии и др.). Приближенно длина связи равна сумме радиусов соседних атомов dA-B = rA + rB.
Как и радиусы атомов, межъядерные расстояния закономерно изменяются в рядах, подгруппах Периодической системы. Например, в ряду HF - HCl - HBr - HI расстояние dH-Г увеличивается (1,0; 1,27; 1,41 и 1,62?, соответственно). Расстояние между одинаковыми атомами в различных соединениях (при одинаковой кратности) близки. Так, ординарные связи C-C в любых соединениях составляют dC-C от 1,54 до 1,58?. Чем выше кратность связи, тем меньше ее длина:
dC-C = 1,54, dC=C = 1,34 и dC≡C = 1,2?
чем больше энергия связи, тем меньше ее длина.
В соединениях, содержащих более двух атомов, важной характеристикой является валентный угол, образуемый химическими связями в молекуле и отражающий ее геометрию. Они зависят от природы атомов (их электронного строения) и характера химической связи (ковалентные, ионные, водородные, металлические, ординарные, кратные). Валентные углы определяют в настоящее время весьма точно теми же методами, что и длины связей.
Например, показано, что молекулы состава AB2 могут быть линейными (CO2) или угловыми (H2O), AB3 - треугольными (BF3) и пирамидальными (NH3), AB4 — тетраэдрическими (CH4), или квадратными (PtCl4)-, или пирамидальными (SbCl4)-, AB5 - тригонально-бипирамидальными (PCl5), или тетрагонально-пирамидальными (BrF5), AB6 — октаэдрическими (AlF6)3- и т.д. Валентные углы закономерно изменяются с изменением порядкового номера в периодической таблице. Например, угол H-Э-H для H2O, H2S, H2Se уменьшается (104,5; 92 и 900,соответственно).
Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
Диполь – система из двух равных, но противоположных по знаку зарядов, находящихся на единичном расстоянии друг от друга. Дипольный момент измеряется в кулон-метрах (Кл?м) или в дебаях (D); 1D = 0,333?10–29 Кл?м.
Зная величину дипольного момента можно сделать заключение о характере химической связи (ионная, ковалентная полярная или неполярная) и о геометрической форме молекулы. Можно ориентироваться на значение разностей электроотрицательностей элементов, входящих в состав бинарной молекулы: если?? 1,7, то связь в этом соединении ковалентно-полярная, а если?? 1,7 - ионная.
Связь между атомами с одинаковой электроотрицательностью, например, H2, Cl2, или близкими значениями электроотрицательности - CH4 не имеет даже небольшого вклада, связанного с разделением зарядов. Такие связи и молекулы называют ковалентными; они неполярны, в них центры тяжести зарядов совпадают. Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма.
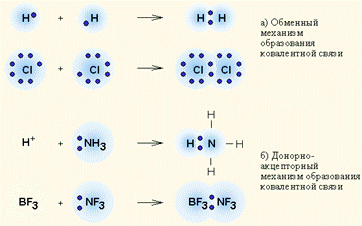
Для образования простой ковалентной связи каждый из атомов предоставляет по одному электрону: А•|•Б. При возникновении донорно-акцепторной связи один атом – донор – предоставляет два электрона, а другой атом – акцептор – выделяет для этого вакантную электронную орбиталь: А: | Б. Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F, О + О = О2. При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной (HCl, H2O): S + O2 = O=S=O.
Кроме поляризуемости ковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. Электронные орбитали (кроме s-орбиталей) имеют пространственную направленность. Поэтому ковалентная связь, являющаяся результатом перекрывания электронных облаков взаимодействующих атомов, располагается в определенном направлении по отношению к этим атомам.
Если перекрывание электронных облаков происходит в направлении прямой, соединяющей ядра взаимодействующих атомов (т. е. по оси связи), то образуется σ -связь (сигма-связь). При взаимодействии p-электронных облаков, направленных перпендикулярно к оси связи, образуются 2 области перекрывания, расположенные по обе стороны от этой оси. Такая ковалентная связь называется π-связью (пи-связь). π-связь может возникнуть не только за счет p-электронов, но также за счет перекрывания d- и p-электронных облаков или d-облаков. Дельта (δ) - связи обязаны перекрыванию всех четырех лопастей d - электронных облаков, расположенных в параллельных плоскостях.

Возможные типы перекрывания химических орбиталей
Исходя из условий симметрии, можно показать, что электроны s-орбиталей могут участвовать только в σ - связывании, р-электроны - уже в σ - и π - связывании, а d - электроны – как в σ - и π -, так и в δ - связывании. Для f - орбиталей типы симметрии еще разнообразнее.
В большинстве молекул связи имеют промежуточный характер (в том числе и в NaCl); такие связи и молекулы называют полярными (или полярными ковалентными), в них “центры тяжести” зарядов не совпадают. Ковалентная связь - наиболее распространенный вид связи, он реализуется в большинстве известных веществ. Соединений с неполярной ковалентной связью и связью, близкой к чисто ионной, существует немного.
Если взаимодействующие атомы отличаются по электроотрицательности, то электронная плотность смещается к более электроотрицательному и атомы, в пределе, превращаются в заряженные ионы. В этом случае между атомами образуется ионная связь. Например, связь в молекуле NaCl можно приближенно представить как кулоновское взаимодействие ионов Na+ и Cl-.
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщенности. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул.
В газообразном состоянии NaCl имеет дипольный момент ~3?10–29 Кл?м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na0,8+Cl0,8–. Атомы металлов обычно отдают электроны, приобретая при этом электронную конфигурацию атома предшествующего инертного газа. Атомы d - и f -элементов, проявляющие переменную валентность, могут иметь и другие устойчивые электронные конфигурации. Атомы неметаллов часто достраивают свой внешний электронный слой. Если в соединении присутствует более электроотрицательный элемент, неметалл может отдавать электроны до обретения устойчивой степени окисления (например, для Cl – это +1, +3, +5, +7). Когда атом металла образует связь с атомом неметалла, первый отдает электроны, а второй принимает. В случае взаимодействия типичного металла с типичным неметаллом между их атомами образуется ионная связь: 2Na + Cl2 = 2NaCl.
В настоящее время для изучения химической связи в основном используют два метода: 1) валентных связей; 2) молекулярных орбиталей.
В рамках первого метода рассматривают индивидуальные атомы, вступающие во взаимодействие, исходя из принципа завершенности электронной оболочки (правило октета). Ковалентная связь с точки зрения метода валентных связей образуется за счет обобществления электронной пары. Простой метод валентных связей для химика наиболее понятен, удобен и нагляден. Недостаток метода валентных связей состоит в том, что в его рамках нельзя объяснить некоторые экспериментальные данные.
Метод валентных связей (МВС) иначе называют теорией локализованных электронных пар, поскольку в основе метода лежит предположение, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые локализованы преимущественно между ними. В МВС связь всегда двухэлектронная и обязательно двухцентровая. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности, в образовании химической связи принимают участие валентные электроны. Волновая функция, описывающая состояние электронов, образующих связь, называется локализованной орбиталью (ЛО).
 2014-01-27
2014-01-27 912
912







