К элементам VII (в новой номенклатуре ЮПАК она обозначена как 17 группа) относятся фтор (F), хлор (Cl), бром (Br), иод (I), астат (At). Название этих элементов - галогены (греч. "рождающие соли") - обусловлено тем, что большинство их соединений с металлами представляют собой типичные соли (KCl, NaCl и т.д.).
Многие соединения галогенов, например, поваренная соль (от лат. sal) известны людям с незапамятных времен. Соляную кислоту (лат. spiritus salis) впервые выделили алхимики сухой перегонкой купоросов, квасцов и поваренной соли. Свободный хлор (от греч. сhloros - желто-зеленый) был получен Карлом Шееле (1742-1786) действием соляной кислоты на пиролюзит (MnO2). Долгое время его называли окисленной муриевой кислотой, считая оксидом элемента мурия (от греч. muria - рассол). Взаимодействие хлора с раствором KOH изучал Клод Бертолле (1748-1822) - выделенный им хлорат калия до сих пор носит его имя.
Проблема выделения свободного фтора (от греч. phthoros - гибель) волновала многие поколения химиков. Однако решить ее удалось лишь в 1886г. Муассану, получившему незначительные количества F2 электролизом HF.
Бром (от греч. bromos - зловонный) был открыт в 1825 г. Балларом из соляного рассола действием пиролюзита в кислой среде.
В 1811 г. из золы морских водорослей Бернаром Куртуа был получен иод (от греч. iodes - фиолетовый).
Астат 85Аt (иногда его называют астатином) получен бомбардировкой ядер висмута  -частицами
-частицами
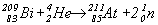 .
.
Ввиду сильной радиоактивности химия соединений астата изучена недостаточно.
Электронная конфигурация и некоторые характеристики атомов галогенов приведены в табл.1.
Таблица 1.Некоторые характеристики атомов галогенов.
| Атом | Электронная конфигурация | Орбитальный атомный радиус, (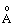 ) )
| Еср Сродство к электрону эВ (кДж/моль) | Eион Первая энергия ионизации эВ(кДж/моль) | ЭО Электроотрица- тельность* ) | Устойчивые степени окисления |
| 9F | [He]2s22p5 | 0.39 | 3.45(333) | 17.42(1682) | 4.1 | -1;0 |
| 17Cl | [Ne]3s23p53d0 | 0.73 | 3.7 (348) | 12.97(1255) | 2.9 | -1;0;+1;+3;(+4); +5; (+6); +7. |
| 35Br | [Ar]3d104s22p54d0 | 0.85 | 3.4(325) | 11.81(1143) | 2.8 | -1; 0; +1; +3; (+4); +5; +7. |
| 53I | [Kr]4d105s25p55d0 | 1.04 | 3.1(295) | 10.47(1012) | 2.2 | -1;0; +1;+3; +5; +7. |
*) По шкале Олреда-Рохова. A.L.Allred, E.G.Rochow. J.Inorg.Nucl.Chem. 1958, 5, 264.
В основном состоянии атомы галогенов имеют электронную конфигурацию ns2np5, где n - главное квантовое число, или номер периода. По сравнению с атомами других галогенов у атомов фтора 2s2 и 2p5 электроны слабо экранированы от ядра, что приводит к высокой удельной (на единицу объема) электронной плотности и, соответственно, меньшему радиусу, большим значениям энергии ионизации и электроотрицательности. При переходе от фтора к иоду размер атомов и возможные координационные числа увеличиваются, а энергии ионизации и электроотрицательность (ЭО) уменьшаются.
Свойства фтора, как и других элементов второго периода (Li-F), отличаются от свойств более тяжелых элементов соответствующих групп. Например, сродство к электрону у фтора меньше, чем у хлора. Это связано с высокой электронной плотностью и сильным межэлектронным отталкиванием. При переходе от хлора к иоду сродство к электрону уменьшается из-за увеличения радиуса атома галогена. К особенностям фтора относится также высокая электроотрицательность, что приводит к тому, что для фтора из всех возможных степеней окисления -1, 0, +1, +3, +5, +7 характерны только две первых. Следует также отметить высокие по сравнению с другими галогенами энтальпии образования ионных и ковалентных фторидов. В случае ионных фторидов это обусловлено небольшим размером иона 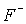 , сильным кулоновским взаимодействием и, соответственно, высокой энергией кристаллической решетки. Высокая энтальпия образования ковалентных фторидов связана с малым радиусом атома фтора (табл.1), с большим по сравнению с другими галогенами перекрыванием атомных орбиталей и, значит, с более прочной ковалентной связью. Например, в молекулах NF3 и NCl3 энергии связи N-X составляют 272 и 193 кДж/моль, соответственно.
, сильным кулоновским взаимодействием и, соответственно, высокой энергией кристаллической решетки. Высокая энтальпия образования ковалентных фторидов связана с малым радиусом атома фтора (табл.1), с большим по сравнению с другими галогенами перекрыванием атомных орбиталей и, значит, с более прочной ковалентной связью. Например, в молекулах NF3 и NCl3 энергии связи N-X составляют 272 и 193 кДж/моль, соответственно.
Галогены проявляют положительные степени окисления в соединениях с более электроотрицательными элементами, например, с фтором (ClF7, IF7, см.12) и кислородом (8, 9,11). Соединения, в которых атом галогена выступал бы как одновалентный катион Х+, неизвестны, поскольку энергетические затраты на ионизацию (табл.1) не компенсируются энергией кристаллической решетки и сольватации. Однако для иода и брома известны комплексные соединения, например, 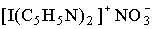 , в которых атом галогена находится в положительной степени окисления +1, +3 (см.3).
, в которых атом галогена находится в положительной степени окисления +1, +3 (см.3).
Астат по своим свойствам напоминает иод, например, идентифицированы соединения HAt, CH3At, BiAt, Ba(AtO3)2. Однако соединения с высшей степенью окисления At (VII) не получены.
Соединения, содержащие поликатионы галогенов 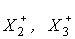 и т.д. рассмотрены в12.3, а соединения, включающие анионные формы полигалогенидов
и т.д. рассмотрены в12.3, а соединения, включающие анионные формы полигалогенидов 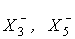 - в12.4.
- в12.4.
 2014-01-31
2014-01-31 892
892








