В парообразном, жидком и твердом состояниях галогены построены из двухатомных молекул Х2. Для оценки энергий молекулярных орбиталей полезна информация об энергиях исходных атомных орбиталей.
На рис.1 представлено изменение энергии ns- и np -атомных орбиталей для атомов элементов первого, второго, третьего и четвертого периодов периодической системы Д.И.Менделеева.
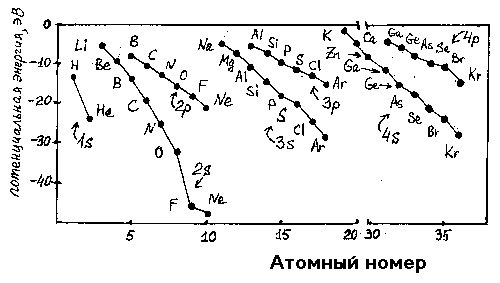
Рис.1. Энергия Е (эВ) ns - и np -атомных орбиталей атомов элементов 1-го, 2-го, 3-го 4-го периодов.
Энергии отрицательны, так как при взаимодействии положительно заряженного ядра и отрицательно заряженных электронов энергия выделяется. При переходе от Li к Ne растут заряд ядра, прочность связи с ядром 2s-электронов и их экранирующее действие на электроны 2p-орбиталей. Таким образом, в этом ряду разница энергии 2s - и 2p -орбиталей увеличивается. Эффект экранирования приводит к увеличению энергии 3s- и 3p-, 4s- и 4p -орбиталей и т.д., а главное, к уменьшению их разности по сравнению с 2s- и 2p -орбиталями: если для фтора разница в энергии орбиталей составляет 27.7 эВ, то для хлора - 11.6 эВ.
|
|
|
Существенное различие энергий 2s- и 2p- орбиталей у фтора, как и у кислорода, приводит к незначительному вкладу 2s- орбиталей в образование 3 св. и 4
св. и 4 разр молекулярных орбиталей. В результате на энергетической диаграмме молекулы F2 орбиталь 3
разр молекулярных орбиталей. В результате на энергетической диаграмме молекулы F2 орбиталь 3 св располагается ниже 1-
св располагается ниже 1- св -орбиталей (рис.2а).
св -орбиталей (рис.2а).
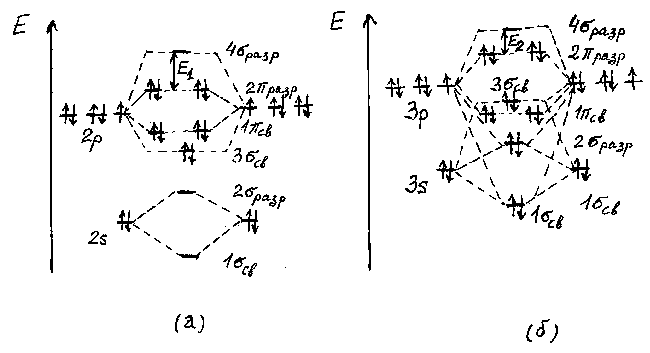
Рис.2. Схема энергетических диаграмм молекулярных орбиталей F2 (a) и Cl2 (б).
При переходе к молекулам Cl2 - Br2 - I2 из-за уменьшения разницы энергий Е(ns)-Е(np) в образовании 3 св-орбиталей участвуют как ns-, так и np- орбитали, поэтому энергия 3
св-орбиталей участвуют как ns-, так и np- орбитали, поэтому энергия 3 св-орбитали оказывается выше энергий 1
св-орбитали оказывается выше энергий 1 св-орбиталей (рис.2б). Таким образом, электронная конфигурация молекул галогенов изменяется от (1
св-орбиталей (рис.2б). Таким образом, электронная конфигурация молекул галогенов изменяется от (1 св) 2 (2
св) 2 (2 разр) 2 (3
разр) 2 (3 св) 2 (1
св) 2 (1 св) 4 (2
св) 4 (2 разр) 4 для фтора к (1
разр) 4 для фтора к (1 св) 2 (2
св) 2 (2 разр) 2 (1
разр) 2 (1 св) 4 (3
св) 4 (3 св) 2 (2
св) 2 (2 разр) 4 - для остальных галогенов. При переходе от фтора к иоду энергия ns- и np- атомных орбиталей увеличивается, а их разность уменьшается. Следует отметить, что при этом уменьшается и разность энергий между наивысшей занятой и наинизшей свободной молекулярными орбиталями: Е1 > Е2 (рис.2). Соотношение между величинами Е1 и Е2 имеет важное значение для объяснения окраски галогенов. Уменьшение разницы энергии ns- и np- орбиталей приводит и к увеличению энергии молекулярных орбиталей. Но отсюда нельзя сделать однозначного вывода относительно изменения в ряду F2-I2 энергии связи Х-Х, так как последняя связана с разницей в энергии молекулярных и атомных орбиталей сложным образом. Однако следует отметить, что наличие электронов на разрыхляющих молекулярных орбиталях приводит к дестабилизации молекулы, особенно при малом ее размере. Например, энергия связи F-F заметно меньше, чем Cl-Cl и Br-Br, и лишь ненамного больше, чем I-I. Это обусловлено малым размером атома фтора и сильным отталкиванием четырех электронов на разрыхляющих орбиталях (рис.2). Такая же особенность в изменении энергий связи характерна и для молекул VI(16), V(15) и IV(14) групп периодической системы элементов.
разр) 4 - для остальных галогенов. При переходе от фтора к иоду энергия ns- и np- атомных орбиталей увеличивается, а их разность уменьшается. Следует отметить, что при этом уменьшается и разность энергий между наивысшей занятой и наинизшей свободной молекулярными орбиталями: Е1 > Е2 (рис.2). Соотношение между величинами Е1 и Е2 имеет важное значение для объяснения окраски галогенов. Уменьшение разницы энергии ns- и np- орбиталей приводит и к увеличению энергии молекулярных орбиталей. Но отсюда нельзя сделать однозначного вывода относительно изменения в ряду F2-I2 энергии связи Х-Х, так как последняя связана с разницей в энергии молекулярных и атомных орбиталей сложным образом. Однако следует отметить, что наличие электронов на разрыхляющих молекулярных орбиталях приводит к дестабилизации молекулы, особенно при малом ее размере. Например, энергия связи F-F заметно меньше, чем Cl-Cl и Br-Br, и лишь ненамного больше, чем I-I. Это обусловлено малым размером атома фтора и сильным отталкиванием четырех электронов на разрыхляющих орбиталях (рис.2). Такая же особенность в изменении энергий связи характерна и для молекул VI(16), V(15) и IV(14) групп периодической системы элементов.
|
|
|
Рассмотрим физические свойства галогенов: магнитные свойства, окраску, температуры фазовых переходов и прочность связи Х-Х (табл.2). Молекулы галогенов диамагнитны, так как не содержат неспаренных электронов (рис.2). Окраска возникает из-за поглощения видимого света, то есть при возбуждении электронов с 2 разр - на 4
разр - на 4 разр-орбитали. При переходе от фтора к иоду разница в энергии (Е) этих орбиталей уменьшается, а длина волны (
разр-орбитали. При переходе от фтора к иоду разница в энергии (Е) этих орбиталей уменьшается, а длина волны (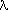 ) (
) (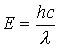 ) поглощенного света увеличивается. Это приводит к смещению полос поглощения от ультрафиолетовой (400 нм) у фтора к желто-зеленой (540-560 нм) у иода. Окраска связана с дополнительным цветом, то есть теми волнами, которые вещество пропускает, а глаз человека воспринимает. Фтор не поглощает свет из видимой части спектра и оказывается бесцветным. Хлор поглощает фиолетовую часть (400-440 нм) видимого спектра, пропускает желто-зеленую часть и, соответственно, имеет эту окраску. В целом, при переходе от фтора к иоду длина волны поглощенного света растет, а окраска изменяется от бесцветной (у фтора) до фиолетовой (у иода).
) поглощенного света увеличивается. Это приводит к смещению полос поглощения от ультрафиолетовой (400 нм) у фтора к желто-зеленой (540-560 нм) у иода. Окраска связана с дополнительным цветом, то есть теми волнами, которые вещество пропускает, а глаз человека воспринимает. Фтор не поглощает свет из видимой части спектра и оказывается бесцветным. Хлор поглощает фиолетовую часть (400-440 нм) видимого спектра, пропускает желто-зеленую часть и, соответственно, имеет эту окраску. В целом, при переходе от фтора к иоду длина волны поглощенного света растет, а окраска изменяется от бесцветной (у фтора) до фиолетовой (у иода).
 2014-01-31
2014-01-31 742
742








