Таблица 3.Химические свойства простых веществ.
Таблица 2.Сравнение свойств молекул и простых веществ.
| Галоген | Цвет | Тпл,оС | Ткип,оС |  Ногом.х), кДж/моль Ногом.х), кДж/моль
|  Ногетер.хх), кДж/моль Ногетер.хх), кДж/моль
|
| F2 | бесцветный | -219.6 | -188.1 | ||
| Cl2 | желто-зеленый | -101.0 | -34.1 | ||
| Br2 | красно-бурый | -7.2 | 59.2 | ||
| I2 | фиолет.(пар) черный (кр.) | 113.6 | 185.5 |
х) Энергия гомолитического разрыва связи Х-Х.
хх) Энергия гетеролитического разрыва связи Х-Х.
Температуры плавления (Тпл.) и кипения (Ткип.) (табл.2) монотонно увеличиваются от фтора к иоду. Этот факт связан с ростом размеров молекул и усилением межмолекулярного взаимодействия (сил Ван-дер-Ваальса).
Хлор, бром и иод слабо растворимы в воде (фтор энергично взаимодействует с водой). Так, при 200С в 100 г воды может быть растворено 0.7 г Cl2; 3.58 г Br2 и 0.028 г I2. Значительно лучше галогены растворимы в неполярных и малополярных органических растворителях (спиртах 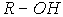 , простых эфирах
, простых эфирах 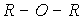 и аминах
и аминах 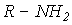 ).
).
Интересно сравнить окраску иода в различных растворителях. Растворы иода в предельных углеводородах, а также CCl4, не имеющих неподеленных электронных пар, окрашены в фиолетовый цвет, подобный парам иода ( погл= 540-560 нм). Это свидетельствует о том, что электроны молекул таких растворителей не вступают во взаимодействие с 4
погл= 540-560 нм). Это свидетельствует о том, что электроны молекул таких растворителей не вступают во взаимодействие с 4 разр орбиталями I2. В донорных растворителях, например, триметиламине
разр орбиталями I2. В донорных растворителях, например, триметиламине 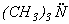 , молекулы которого имеют неподеленную электронную пару, напротив, растворимость иода увеличивается, а растворы приобретают коричневую окраску. Причина этого заключается в образовании комплексного соединения, например, (CH3)3N
, молекулы которого имеют неподеленную электронную пару, напротив, растворимость иода увеличивается, а растворы приобретают коричневую окраску. Причина этого заключается в образовании комплексного соединения, например, (CH3)3N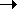 I-I. Взаимодействие донорной орбитали растворителя с
I-I. Взаимодействие донорной орбитали растворителя с 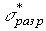
 молекулярной орбиталью иода приводит к образованию более низкой по энергии связывающей А-орбитали и более высокой по энергии разрыхляющей В-орбитали (рис.3).
молекулярной орбиталью иода приводит к образованию более низкой по энергии связывающей А-орбитали и более высокой по энергии разрыхляющей В-орбитали (рис.3).
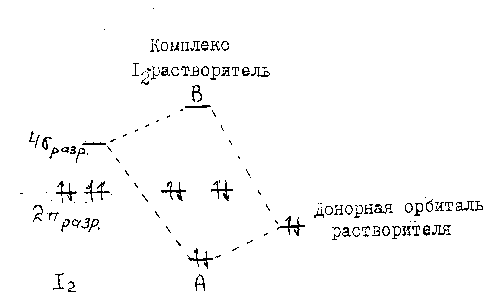
Рис.3. Взаимодействие 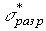 орбитали I2 с донорной орбиталью растворителя.
орбитали I2 с донорной орбиталью растворителя.
В результате энергия перехода 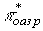
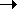 В увеличивается по сравнению с энергией перехода
В увеличивается по сравнению с энергией перехода 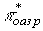
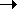
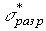 в молекуле I2, а длина волны (
в молекуле I2, а длина волны (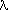 ) поглощенного света уменьшается от 540-560 нм в случае иода до 460-480 нм для сольвата. Раствор сольвата пропускает более длинноволновое красное, желтое и зеленое излучение, смешивание которых приводит к коричневой окраске. В ряде случаев сольваты выделены в кристаллическом виде (например, с ацетонитрилом, пиридином).
) поглощенного света уменьшается от 540-560 нм в случае иода до 460-480 нм для сольвата. Раствор сольвата пропускает более длинноволновое красное, желтое и зеленое излучение, смешивание которых приводит к коричневой окраске. В ряде случаев сольваты выделены в кристаллическом виде (например, с ацетонитрилом, пиридином).
При нагревании растворов иода в донорных растворителях происходит смена коричневой окраски на фиолетовую, что связано с распадом сольватов. При охлаждении коричневое окрашивание восстанавливается.
3. Прочность связи Х-Х и химические свойства простых веществ.
Кратность связи в молекулах галогенов равна единице. Их химические свойства связаны с особенностями разрыва этой связи. Она может разорваться гомо- или гетеролитически. В первом случае электронная плотность распределяется поровну между частицами
Х: Х = Х . + Х . (1),
так, что образуются два атома Х . с неспаренным электроном. Во втором случае электронная плотность смещается к одному из атомов
Х: Х = 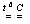 +
+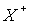 (2),
(2),
так что образуются положительная 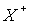 и отрицательная
и отрицательная 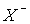 частицы.
частицы.
Энергия гомолитического распада (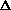 H гом), или энергия связи Х-Х изменяется немонотонно: увеличивается от фтора к хлору, а от хлора к иоду уменьшается (см.2 и табл.2).
H гом), или энергия связи Х-Х изменяется немонотонно: увеличивается от фтора к хлору, а от хлора к иоду уменьшается (см.2 и табл.2).
Энергию гетеролитического распада (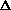 H гетер)
H гетер)
Х2 = 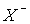 +
+ 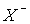 +
+ 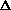 H гетер (3)
H гетер (3)
можно вычислить комбинированием энергии 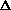 H гом (табл.2), энергии ионизации (табл.1)
H гом (табл.2), энергии ионизации (табл.1)
Х - 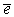 =
= 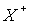 + Еион (4)
+ Еион (4)
и энергии сродства к электрону (табл.1)
Х + 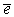 =
= 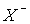 - Еср (5)
- Еср (5)
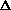 H гетер =
H гетер = 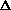 H гом + Еион - Еср (6)
H гом + Еион - Еср (6)
Величины 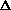 H гетер (табл.2) монотонно уменьшаются в ряду фтор-хлор-бром-иод. Это объясняется тем, что наибольший вклад в нее вносят энергии ионизации (Еион), которые в группе галогенов уменьшаются монотонно (табл.1).
H гетер (табл.2) монотонно уменьшаются в ряду фтор-хлор-бром-иод. Это объясняется тем, что наибольший вклад в нее вносят энергии ионизации (Еион), которые в группе галогенов уменьшаются монотонно (табл.1).
Наиболее вероятен гетеролитичекий распад для иода, поскольку энергия, затрачиваемая в таком процессе наименьшая и может быть скомпенсирована энергией кристаллической решетки или энергией сольватации и т.д.
Например, выделено соединение 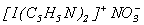 , в котором энергетические затраты скомпенсированы образованием сильной ковалентной связи между катионами I+ и основанием Льюиса (донором электронной пары) - пиридином C5H5N.
, в котором энергетические затраты скомпенсированы образованием сильной ковалентной связи между катионами I+ и основанием Льюиса (донором электронной пары) - пиридином C5H5N.
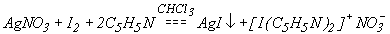
При взаимодействии с неметаллами и металлами связь в молекулах Х2 чаще всего разрывается по гомолитическому механизму. Этому способствуют нагревание, освещение, катализаторы. Основные химические свойства простых веществ представлены в табл.3.
| Неметаллы | Фтор | Хлор | Бром | Иод |
| He, Ne, Ar | Не взаимодействуют. | |||
| Kr, Xe | ЭFn, n = 2,4,6. | Не взаимодействуют. | ||
| Галогены | XF (X=Cl, Br, I); BrCl, ICl, IBr XF3 (X=Cl, Br, I); I2Cl6 XF5 (X=Cl, Br, I) XF7 (X=I) | |||
| О2 | F2O2 (в электр.разряде) | Не взаимодействуют. | ||
| S | SF6, S2F10 | S2Cl2, SCl2,SCl4 | S2Br2 | Не реагирует. |
| N2 | Не взаимодействуют. | |||
| P | PХ3 и РХ5 | PI3, P2I4, PI5(?) | ||
| H2 | Со взрывом в темноте | Со взрывом на свету. | Реагирует выше 2000С; Pt -катализатор | Равновесие H2+Г2=2НГ смещено влево |
| Металлы | Загораются | Реагируют при нагревании. |
По химическим свойствам галогены - самые активные неметаллы. Из-за низкой энергии диссоциации (табл.2) и высокой энергии гидратации иона 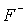 наиболее реакционно-способным из галогенов оказывается фтор. Он взаимодействует непосредственно со всеми элементами Периодической таблицы Д.И.Менделеева, кроме He, Ne, Ar. В атмосфере фтора сгорают вода
наиболее реакционно-способным из галогенов оказывается фтор. Он взаимодействует непосредственно со всеми элементами Периодической таблицы Д.И.Менделеева, кроме He, Ne, Ar. В атмосфере фтора сгорают вода
2H2O + 2F2 = 4HF + O2
и стеклянная вата
SiO2 + 2F2 = SiF4 + O2 .
Если же элемент может проявлять несколько степеней окисления, то, как правило, образуются высшие возможные фториды (SF6 , VF5, XeF6 и т.д.).
Взаимодействие фтора с некоторыми переходными металлами, например, никелем, протекает крайне медленно из-за образования на их поверхности тонкой защитной пленки соответствующего фторида металла.
Взаимодействие галогенов с водой и щелочами рассмотрено в 10. От фтора к иоду окислительная способность уменьшается, а восстановительная - увеличивается.
В качестве примера рассмотрим процессы, протекающие при пропускании хлора в водный раствор иодида калия KI. Сначала хлор, как более сильный окислитель, вытесняет иод из иодида калия, что приводит к появлению окраски:
2KI + Cl2 = I2 + 2KCl.
Далее избыток хлора окисляет иод, и раствор при этом обесцвечивается:
I2 + Cl2 +6H2O = 2HIO3 + 10HCl.
Другим примером восстановительных свойств иода может служить получение иодноватой кислоты HIO3:
3I2(тв.) + 10HNO3(конц) = 6HIO3 + 10NO2 + 2H2O.
Фтор встречается в природе в виде фторидов, например, флюорита CaF2. Фтор получают электролизом расплавов фторидов щелочных металлов. Для понижения температуры плавления электролизу подвергают кислые фториды состава KF. 2HF * ), что позволяет проводить процесс при 1000С (Тпл. чистого KF составляет 8570С). Материалом для электролизера служат медь, никель или сталь, которые покрываются с поверхности плотной пленкой фторида, препятствующей дальнейшей коррозии реактора.
В лабораторных условиях фтор можно получить термолизом высших фторидов некоторых металлов, например,
2CeF4 = 2CeF3 + F2.
Хлор встречается в природе, в основном, в виде хлоридов. Например, известны мощные залежи галита(NaCl), образовавшиеся при испарении соленых морей и озер. Основным методом получения хлора из галита является электролиз концентрированного раствора NaCl с диафрагмой, разделяющей катодное и анодное пространства:
2 NaCl + 2H2O 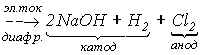
В лабораторных условиях хлор получают взаимодействием концентрированной HCl с такими окислителями, как КMnO4 , а также MnO2, K2Cr2O7 и т.д.
16HCl + 2KMnO4 = Cl2 +2KCl +2MnCl2 + 8H2O.
Реакция твердого KMnO4 с концентрированной HCl протекает с образованием темно-коричневого малорастворимого гексахлороманганата (IV) калия и раствора, содержащего хлоридные комплексы Mn(III):
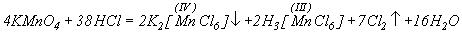
Полное восстановление KMnO4 до MnCl2 осуществляется при большом избытке HCl.
Бром, содержащийся в морской воде и буровых водах в виде бромидов, извлекают путем обработки реакционной смеси хлором при рН=3.5, чтобы избежать образования солей оксокислот брома.
Аналогичным образом из буровых вод и золы, образующейся при сгорании морских водорослей, выделяют иод.
В лаборатории бром и иод получают взаимодействием галогенидов с окислителем (MnO2) в кислой среде, например:
MnO2 + 2H2SO4 + 2KI = I2 + MnSO4 + 2H2O + K2SO4..
Образующийся иод экстрагируют или отделяют перегонкой с водяным паром.
 2014-01-31
2014-01-31 893
893







