Зависимость константы равновесия от температуры можно получить, дифференцируя по T уравнение (14) как сложную функцию в изобарных условиях:
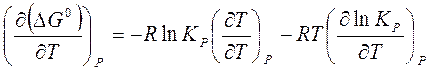 или
или
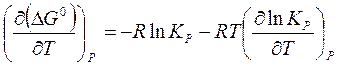 . (16)
. (16)
Преобразуем выражение (16) с учетом уравнения изотермы (14):
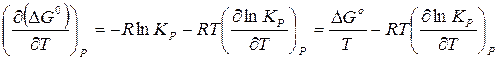 , (17)
, (17)
где 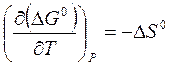 .
.
Таким образом, уравнение (17) примет вид
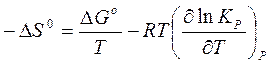 . (18)
. (18)
Решая уравнение (18) относительно 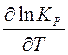 , получаем уравнение:
, получаем уравнение:
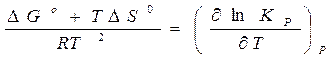 ,
,
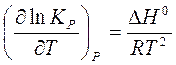 или
или 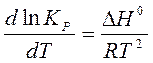 . (19)
. (19)
Аналогичным образом можно вывести выражение и для зависимости КС от температуры:
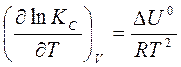 или
или 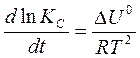 . (20)
. (20)
Уравнения (19) и (20) называют уравнениями изобары и изохоры химической реакции в дифференциальной форме, соответственно.
Из этих уравнений следует, что влияние температуры на константу равновесия определяется знаком теплового эффекта.
Если реакция эндотермическая, т.е.
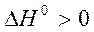 , то
, то 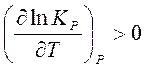
и с повышением температуры константа равновесия будет расти, равновесие будет смещаться в сторону продуктов реакции.
Если реакция экзотермическая, т.е.
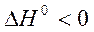 , то
, то 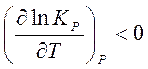
то с повышением температуры константа равновесия будет уменьшаться, равновесие будет смещаться в сторону реагентов. Эти качественные выводы о влиянии температуры на химическое равновесие согласуются с принципом Ле Шателье – Брауна.
При интегрировании уравнения изобары необходимо знать температурную зависимость энтальпии 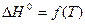 . Если расчеты равновесий проводятся в небольшом температурном интервале, можно принять, что энтальпия реакции постоянна. Тогда интегрирование уравнения (19) в пределах от Т1 до Т2 дает возможность рассчитать ΔН0 реакции, зная константы равновесия при двух различных температурах:
. Если расчеты равновесий проводятся в небольшом температурном интервале, можно принять, что энтальпия реакции постоянна. Тогда интегрирование уравнения (19) в пределах от Т1 до Т2 дает возможность рассчитать ΔН0 реакции, зная константы равновесия при двух различных температурах:
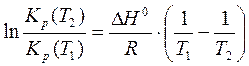 . (21)
. (21)
Уравнение (21) также позволяет по известным величинам ΔН0 реакции и константы равновесия при одной температуре, рассчитать константу равновесия при другой температуре.
Неопределенное интегрирование уравнения (19) приводит к уравнению прямой линии:
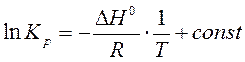 ,
,
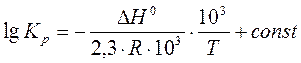
и дает возможность определить ΔН0 реакции графическим способом из угла наклона прямой: 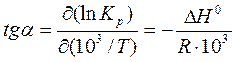 .
.
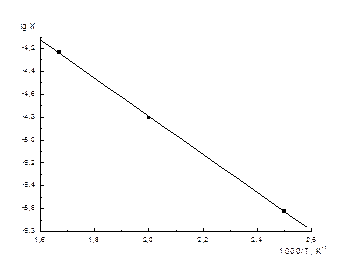
 2014-01-31
2014-01-31 981
981








