Порядок выполнения работы. В большую широкогорлую пробирку (15х1,5 см) помещают 0,1 г сухих пекарских дрожжей, 4 мл 10%-ного раствора серной кислоты, закрывают пробкой, в которую вставлена в качестве холодильника трубка 25-30 см. (см. рисунок на с. 22). Гидролиз проводят путем нагревания на плитке около часа, считая с момента закипания. После окончания гидролиза жидкость охлаждают и фильтруют через складчатый фильтр. При гидролизе образуются следующие продукты:

С фильтратом проделывают следующие реакции.
1. Биуретовая реакция на полипептиды (см. занятие 1). Для выполнения реакции нейтрализовать кислую среду гидролизата до щелочной.
2. Проба на пуриновые основания. К 10 каплям фильтрата добавляют 2-3 капли концентрированного раствора аммиака для нейтрализации и 5 капель 1%-ного раствора нитрата серебра. При стоянии выпадает рыхлый осадок бурого цвета, обусловленный образованием серебряных соединений пуриновых оснований (соблюдать PН среды).
3. Качественные реакции на углевод (рибозу или дезоксирибозу), основанные на способности рибозы и дезоксирибозы, имеющих свободный гликозидный гидроксил восстанавливать медь. А, Проба Троммера заключается в восстановлении окисной меди в закисную. Реакция протекает по следующему уравнению:

Ход выполнения работы. К 5 каплям гидролизата добавляют 5 капель 30%-ного раствора едкого натра и несколько капель 7%-ного раствора сульфата меди до появления неисчезающей мути гидроокиси меди Cu(OH)2. При нагревении до кипения выпадает желтый осадок гидрата закиси меди CuOH или красный осадок закиси меди Cu2O.
Избыток CuSO4 мешает реакции, так как приводит к образованию большого количества Cu(OH)2, который при нагревании распадается с образованием черного осадка окиси меди

Молибденовая проба на фосфорную кислоту. К 5 каплям гидролизата добавляют 10 капель молибденового реактива, представляющего собой раствор молибденовокислого аммония в азотной кислоте, и кипятят. При охлаждении пробирки под струей холодной водопроводной воды выпадает кристаллический осадок лимонно-желтого цвета, обусловленный образованием фосфорномолибденовокислого аммония

Опыт 2. Гидролиз казеина и открытие в гидролизате фосфорной кислоты
В молоке содержится сложный белок казеин, который относится к фосфорпротеидам. Фосфорпротеиды в качестве небелковой части содержат остаток фосфорной кислоты. Фосфорная кислота связана с белком через гидроксильную группу оксиаминокислот: серина и треонина.
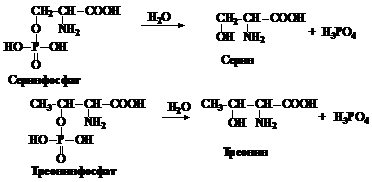
Ход выполнения опыта. В большую широкогорлую пробирку (15х1,5 см) помещают 4 мл молока, приливают 4 мл 10%-ного раствора NaOH, закрывают пробкой, в которой вставлена трубка длиной 25-30 см, и закрепляют так же, как и при гидролизе нуклеопротеидов дрожжей. Гидролиз проводят при нагревании около получаса, считая с момента закипания, жидкость охлаждают, нейтрализуют концентрированной азотной кислотой до слабокислой реакции на лакмус (12-15 капель). При этом выпадает осадок неполного гидролиза белка. Его отфильтровывают и с фильтратом проделывают молибденовую пробу на фосфорную кислоту (см. предыдущую работу). Выпадает кристаллический осадок лимонно-желтого цвета, обусловленный образованием фосфорномолибденовокислого аммония (см. молибденовую пробу).
Опыт 3. Выделение казеина из молока
В молоке казеин находится в виде растворимой кальциевой соли. При подкислении молока до рН 4,7 (изоэлектрическая точка) выпадает в осадок казеин (в форме электронейтральных молекул).
Ход выполнения работы. К 2 мл молока добавляют 2 мл дистиллированной воды и 2 капли 10%-ного раствора уксусной кислоты. Образуется осадок казеина, который отфильтровывают, фильтрат отбрасывают, а с осадком казеина проделывают общие цветные реакции на белки.
Опыт 4. Выделение гликопротеида из слюны и нафтоловая проба на углеводный компонент
При гидролизе различные гликопротеиды дают наряду с аминокислотами углевод.
В пробирку собирают 2 мл слюны и по каплям (4-5 капель) прибавлят концентрированную уксусную кислоту до выпадения в осадок гликопротеида ( тривиальное название муцин). Жидкость осторожно сливают, задерживая сгусток муцина стеклянной палочкой. Со сгустком муцина проделывают нафтоловую пробу на его углеводную часть. Реакция обусловлена тем, что при действии концентрированной серной кислоты из глюкозы образуется оксиметилфурфурол, который, конденсируясь с a-нафтолом, образует соединение, имеющее фиолетовое окрашивание.
К сгустку муцина добавляют 1-2 капли 1%-ного спиртового раствора a-нафтола, перемешивают и осторожно по стенке пробирки наслаивают концентрированную серную кислоту (в объеме, равном содержимому пробирки). На границе двух слоев жидкости постепенно появляется окрашенное кольцо, хорошо заметное на белом фоне

Указания к составлению отчета: результаты реакций записывают в таблицу.
Таблица
| Название белков | Название простетической группы | Структура простетической группы | Употребляемые реактивы | Продукты реакции | Окрашивание | Чем обусловлена реакция |
В выводах приводятся названия сложных белков, структура которых доказана цветными реакциями.
Вопросы к отчету по теме «Сложные белки»
1. Классификация сложных белков. В чем заключается отличие сложных белков от простых?
2. Напишите схему распада нуклеопротеидов.
3. В чем отличие отдельных мононуклеотидов? Каковы продукты их гидролиза?
4. Напишите АТФ, ЦТФ, УДФ, АМФ, УМФ.
5. Как соединяются между собой мононуклеотиды в молекуле нуклеиновых кислот?
6. Напишите: ФАФГФЦФУ, ЦФАФТФГФ.
7. Что такое ДНК и РНК?
8. Какова структурная организация ДНК?
9. Какие виды РНК существуют? Чем они различаются? Каковы их функции?
10. Что такое фосфопротеиды? Как связана фосфорная кислота с белковой частью в фосфопротеидах?
11. Что такое гликопротеиды? Какие продукты образуются при гидролизе углеводной части гликопротеидов?
Занятие 4. Ферменты
Ферменты относятся к простым или сложным белкам. В простетическую группу некоторых ферментов входят витамины, например, рибофлавин является составной частью флавиновых ферментов, а тиамин – некоторых декарбоксилаз. Физико-химические свойства ферментов обусловлены их белковой природой: при их выделении методами высаливания, фракционирования они не теряют каталитических свойств. Ферменты имеют ряд существенных отличий от неорганических катализаторов: они термолабильны, их действие строго специфично, активность изменяется в зависимости от рН и присутствия электролитов, активирующих или парализующих действие ферментов.
 2018-03-09
2018-03-09 2345
2345
