Физические свойства алкенов (температуры кипения, плотности и т.д.) подобны свойствам соответствующих алканов (см. табл. 4.2).
Таблица 4.2
Физические свойства алкенов
| Соединение | Формула | Тпл., °С | Ткип., °С | Плотность d420 |
| Этен (этилен) | СН2=СН2 | -169,2 | -103,8 | 0,5699* |
| Пропен | СН3-СН=СН2 | -185,2 | -47,7 | 0,5193* |
| 1-Бутен | СH2=CH-CH2CH3 | -185,3 | -6,3 | 0,5951* |
| цис-2-Бутен | CH3-CH=CH-CH3 | -138,9 | 3,7 | 0,6213 |
| транс-2-Бутен | CH3-CH=CH-CH3 | -105,9 | 0,9 | 0,6042 |
| 2-Метил-1-пропен | (CH3)2=CH2 | -140,8 | -6,9 | 0,5942* |
| 1-Пентен | CH2=CH-(CH2)2-CH3 | -165,2 | 30,0 | 0,6405 |
| цис-2-Пентен | CH3-CH2-CH=CH-CH3 | -151,4 | 36,9 | 0,6556 |
| транс-2-Пентен | CH3-CH2-CH=CH-CH3 | -140,2 | 36,4 | 0,6482 |
| 2-Метил-1-бутен | CH2=C(CH3)-CH2-CH3 | -137,6 | 31,2 | 0,650 |
| 3-Метил-1-бутен | CH2=CH-CH(CH3)-CH3 | -168,5 | 20,1 | 0,633 |
| 2-Метил-2-бутен | CH3-C(CH3)=CH-CH3 | -133,16 | 38,6 | 0,662 |
| 1-Гексен | CH2=CH-(CH2)3-CH3 | -139,8 | 63,5 | 0,673 |
| 1-Гептен | CH2=CH-(CH2)4-CH3 | -119 | 93,6 | 0,697 |
| 1-Октен | CH2=CH-(CH2)5-CH3 | -101,7 | 121,3 | 0,716 |
| 1-Децен | CH2=CH-(CH2)7-CH3 | -66,3 | 170,6 | 0,740 |
| 1-Октадецен | CH2=CH-(CH2)15-CH3 | 18 | 179 при 15 мл | 0,791 |
* – при температуре кипения.
Первые четыре члена гомологического ряда этиленовх углеводородов – газы. Олефины с числом атомов углерода С5-С17 – жидкости. Высшие алкены, начиная с С18 – твердые вещества.
Олефины с нормальной цепью углеродных атомов кипят при более высокой температуре, чем их изомеры с разветвленной цепью. Перемещение двойной связи в центр молекулы вызывает повышение температуры кипения. Цис-изомеры кипят при более высокой температуре, чем транс-изомеры.
Особого внимания заслуживает сравнение термодинамической устойчивости изомерных алкенов. Ниже в качестве примера приводится ряд возрастания термодинамической устойчивости изомерных бутенов (ряд составлен на основе экспериментальных данных теплот гидрирования):

Дизамещенные алкены (цис- и транс-2-бутены) более устойчивы, чем монозамещенные (1-бутен) вследствии электронодонорного эффекта метильных групп. Транс-2-бутен более устойчив, чем цис-2-бутен вследствие наличия в последнем пространственного отталкивания метильных групп, находящихся у соседних атомов углерода:
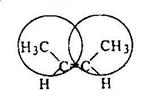
Хотя различия в энергиях образования изомерных цис- и транс-алкенов составляет не более 1 ккал/моль, энергия активации для перехода одного изомера в другой очень велика, около 65 ккал/моль. Это объясняется тем, что указанный переход требует разрыва π-связи. Геометрические изомеры – цис- и транс-алкены – являются, таким образом, конфигурационными изомерами.
Высокий энергетический барьер взаимных превращений цис- и транс-изомерных алкенов обусловлен особенностями электронной структуры алкенов.
 2018-02-14
2018-02-14 603
603








