Электронное строение алкенов иллюстрируется ниже на примере этилена.
В терминах правила октетов электронное строение этилена представляется следующей формулой Льюиса
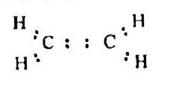
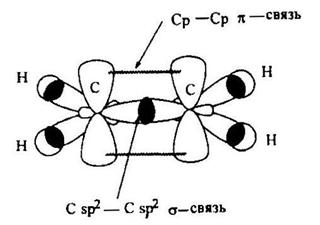
В терминах гибридизации атомных орбиталей двойная связь образована за счет перекрывания вдоль линии С-С-связи sp2-гибридных орбиталей атомов углерода (σ-связь) и бокового перекрывания негибридизованных углеродных р-орбиталей (π-связь).
В терминах теории МО (метод МОХ) линейная комбинация двух атомных рπ-орбиталей атомов углерода формирует две π-МО этилена, связывающую φ1 и разрыхляющую φ2 (рис. 4.1).
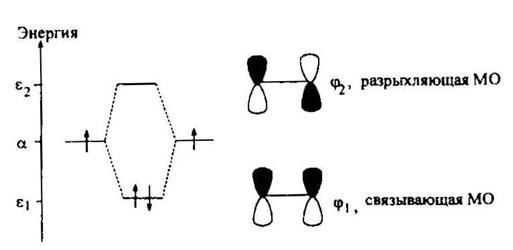
Рис. 5.1. Формирование π-МО этилена
Рассчитанные значения энергий и собственных коэффициентов π-МО этилена приведены ниже
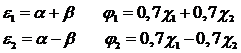
По сравнению с алканами алкены значительно легче ионизируются.
Первый потенциал ионизации этилена составляет лишь 10,5 эВ, при этом электрон уходит с занятой π-орбитали, которая является в молекуле этилена высшей занятой молекулярной орбиталью (ВЗМО).
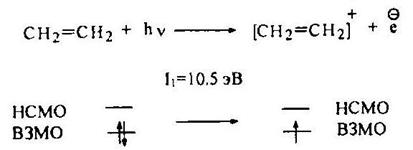
По сравнению с алканами алкены имеют более высокое сродство к электрону. В частности, первое значение электронного сродства этилена, равное -1,78 эВ, соответствует тому, что избыточный электрон достаточно легко (по сравнению с алканами) «садится» на низшую свободную молекулярную орбиталь (НСМО) с образованием анион-радикала этилена.
Соответственно указанным значениям I1 и А1 жесткость электронной оболочки молекулы этилена оценивается сравнительно низкой величиной
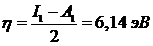 ,
,
что значительно ниже, нежели у алканов (сравни 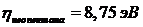 ).
).
Вследствие электронодонорного эффекта алкильных групп гомологи этилена ионизируются еще легче; в частности, первые потенциалы ионизации пропена и цис-бутена равны соответственно 9,73 и 9,12 эВ.
Еще одним доказательством электронодонорного эффекта метильных групп, связанных с двойной связью, является отличный от нуля дипольный момент цис-2-бутена:
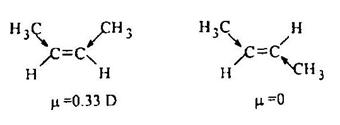
В полном согласии с этими параметрами электронной структуры находится значительно более высокая реакционная способность алкенов по сравнению с алканами. Пространственная и энергетическая доступность π-МО алкена объясняет его повышенную склонность, прежде всего, к реакциям электрофильного присоединения.
5.5. РПЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ПРИСОЕДИНЕНИЯ (АЕ)
Электрофильное присоединение (АЕ) – присоединение, в котором в скоростьлимитирующей стадии атакующей частицей является электрофил. Как правило, реакции электрофильного присоединения начинаются со стадии образования π-комплекса. При этом молекула алкена выступает в качестве π-донора. Эта стадия протекает быстро, не влияет на скорость всего процесса и часто в схемах механизмов опускается.
 2018-02-14
2018-02-14 949
949