Стадия 1 – образование π-комплекса:

Стадия 2 – образование промежуточного σ-комплекса, циклического бромониевого иона::

Циклический бромониевый ион более стабилен, чем открытый 2-бромэтилкатион. Причина такой стабильности состоит в том, что в циклическом бромониевым ионе все атомы имеют по восемь электронов на внешнем электронном уровне, в то время как в 2-бромэтил-катионе у атома углерода имеется лишь шесть электронов. Очевидно, что образование циклического бромониевого иона сопровождается гетеролитическим разрывом связи Br-Br и отщеплением бромида иона.
Стадия 3 – присоединение бромид-иона, протекающее как анти-присоединение к циклическому бромониевому иону:

Бромониевый ион – катион, имеющий положительный заряд на атоме брома.
Анти-присоединение – присоединение фрагментов атакующего реагента с противоположных сторон относительно плоскости молекулы алкена.
Доказательства справедливости такого механизма реакции следует из стереохимии присоединения брома к некоторым алкенам:
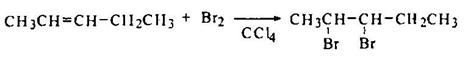
Ниже показана стереохимия присоединения брома к (Z)- и (Е)-2- пентенам и к циклогексену.


Вследствие равновероятности присоединения  по атомам 2 и 3 в результате реакции (Z)-2-пентена с Br2 образуется пара энантиомеров 2,3-дибромпентана трео-ряда в виде рацемата.
по атомам 2 и 3 в результате реакции (Z)-2-пентена с Br2 образуется пара энантиомеров 2,3-дибромпентана трео-ряда в виде рацемата.
Присоединение брома к (Е)-2-пентену по той же схеме дает пару энантиомеров (2S,3R- и 2R,3S-) 2,3-дибромпентана эритро-ряда также в виде рацемата.
Реакция брома с циклогексеном также протекает как анти-присоединение с промежуточным образованием циклического бромониевого иона и приводит к образованию только транс-1,2-дибромциклогексана в наиболее устойчивой (е,е)-конформации.

Смешанные галогены присоединяются к алкенам в соответствии с поляризацией связи Hal-Hal.

Начальной стадией при этом является образование более устойчивого карбокатиона.

Присоединение хлора к алкену также протекает с промежуточным образованием циклического хлорониевого иона. При этом, однако, нужно иметь в виду, что склонность хлора к образованию такого иона существенно меньше и существуют примеры присоединения хлора, протекающего с промежуточным образованием открытой формы карбокатиона.
Гидратация.
Гидратацией называют реакцию присоединения воды.
Гидратация алкенов также протекает, как реакция АЕ. осуществить гидратацию можно двумя путями:
а) присоединением серной кислоты к алкену (при этом соблюдается правило Марковникова) с последующим гидролизом образующейся алкилсерной кислоты; по такой схеме с алкенами реагирует концентрированная серная кислота:

б) действием разбавленных минеральных кислот:

Ниже приводится механизм гидратации алкенов разбавленными минеральными кислотами.
Стадия 1 – образование промежуточного карбокатиона:

Стадия 2 – присоединение воды как нуклеофила:

Стадия 3 – депротонирование алкоксониевого иона, протекающее как кислотно-основное взаимодействие:

И в этих условиях гидратация несимметричных алкенов протекает по правилу Марковникова.
Оксимеркурирование.
В водной среде алкены реагируют с ацетатом ртути с образованием ртутьорганического соединения:

Эту реакцию называют оксимеркурированием.
При обработке получаемого ртутьорганического соединения борогидратом натрия образуются спирты. Эту реакцию называют демеркурированием:

Таким образом, в результате оксимеркурирования алкена и последующего демеркурирования ртутьпроизводного образуется спирт, причем гидратация алкена по завершении обеих стадий происходит по правилу Марковникова. Соответствующие спирты из алкенов образуются с высокими выходами (80-90 %). Реакция оксимеркурирования – демеркурирования является поэтому прекрасным лабораторным методом гидратации алкенов.
Механизм оксимеркурирования основан на ионизации ацетата ртути с образованием катиона CH3COOHg+. Этот катион реагирует с углерод-углеродной двойной связью так же, как и протон. Однако в отличие от прямой гидратации алкенов (когда промежуточно образуются карбокатионы, склонные к перегруппировкам) в данной реакции образуется минимальное количество побочных продуктов.
Стадия 1 – ионизация ацетата ртути:

Стадия 2 – образование промежуточного карбокатиона:

Стадия 3 – стабилизация промежуточного карбокатиона:

Гидроборирование.
Гидроборированием называют процесс присоединения диборана к алкенам:

Процесс гидроборирования, приводящий к триалкилборану, протекает ступенчато, с образованием последовательно моноалкилборана, диалкилборана и триалкилборана:

При взаимодействии диборана с несимметричными алкенами бор присоединяется к наиболее гидрированному атому углерода:

Такому присоединению способствуют и пространственный, и электронный факторы.
Так, атом бора больше атома водорода и более вероятна его взаимодействие с наименее пространственно затрудненным атомом углерода.
Хотя присоединение диборана к алкену представляют как одностадийный процесс с циклическим переходным состоянием,
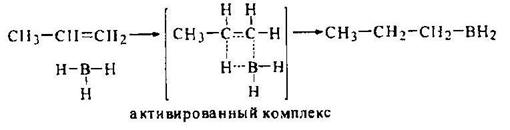
разрыв и образование отдельных связей не протекает в нем одновременно (синхронно). Образование связи С–В несколько опережает образование связи С–Н, так что переходное состояние приобретает катионоидный характер. Его энергетика определяется поэтому теми же факторами, что и в реакциях АЕ-типа: локализация положительного заряда на вторичном С-атоме (активированный комплекс 1) более предпочтительна, чем на первичном (активированный комплекс 2):

Связь бор-углерод весьма лабильна. Поэтому образующиеся в результате гидроборирования легко подвергаются дальнейшим превращениям. Так, при их окислении пероксидом водорода в щелочной среде образуются спирты:

В результате этих превращений олефины претерпевают гидратацию против правила Марковникова.
При обработке триалкилборанов карбоновыми кислотами образуются алканы. Так как образование триалкилборана протекает через циклическое переходное состояние, продуктом превращения является цис-изомер, а присоединение водорода к двойной связи, в целом, рассматривается как син-присоединение. Продуктом такого превращения является цис-аддукт:

Син-присоединение – присоединение фрагментов атакующего реагента с одной и той же стороны относительно плоскости молекулы субстрата.
 2018-02-14
2018-02-14 5974
5974








