При взаимодействии алкенов с хлорноватистой кислотой действием хлора в водной среде получают хлоргидраты алкенов, например, пропиленхлоргидрин.
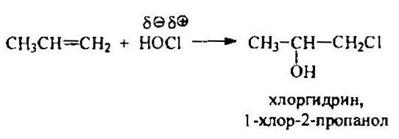
Реакция так же подчиняется правилу Марковникова: электрофильный хлор направляется к более гидрированному атому углерода.
Часто для получения хлоргидринов из алкенов в качестве реагентов используют хлор и воду:
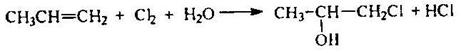
Эта реакция также протекает по механизму АЕ.
Стадия 1 – образование π-комплекса:
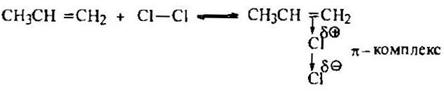
Стадия 2 – образование промежуточного карбокатиона (σ-комплекса):
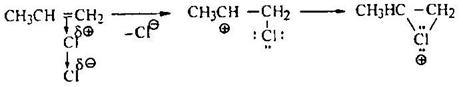
Так как хлор обладает высокой электроотрицательностью, открытая форма хлорониевого иона представляется наиболее вероятной. Доказательством этого является отсутствие стереоспецифичности в реакциях образования хлоргидринов.
Стадия 3 – взаимодействие промежуточного карбокатиона с водой как нуклеофилом:
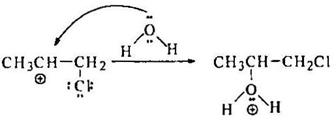
Стадия 4 – депротонирование алкоксониевого иона:
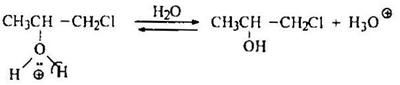
В ряду гомологов этилена, чем более замещенным является алкен, тем выше его реакционная способность в реакциях электрофильного присоединения. Это объясняется тем, что алкильные группы стабилизируют промежуточно образующийся карбокатион.
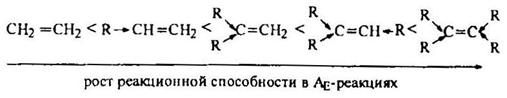
Присоединение алканов. Алкилирование.
Изобутан и изобутилен реагируют в присутствии кислого катализатора образуя 2,2,4-триметилпентан, или «изооктан»:
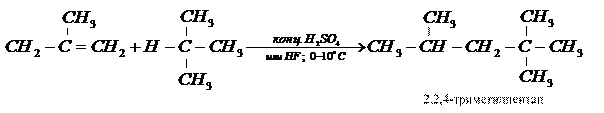
Механизм реакции:
1.
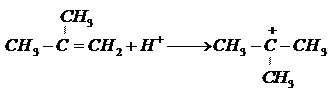
2.
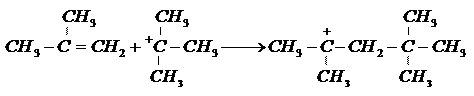
3.
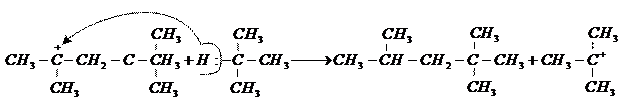
Затем (2), (3), (2), (3) и т.д.
Первые две стадии такие же, как и в реакции димеризации. На стадии (3) карбониевый ион вырывает атом водорода с его парой электронов (гидрид-ион) из молекулы алкана, а новый карбониевый ион продолжает цепь.
5.6. РЕАКЦИИ РАДИКАЛЬНОГО ПРИСОЕДИНЕНИЯ (AR)
В условиях, способствующих гомолитическому разрыву связей (газовая фаза, освещение, воздействие повышенной температуры, присутствие пероксидов), присоединение к алкенам протекает по радикальному цепному механизму.
Галогенирование.
Галогенирование пропена ведет к образованию 1,2-дибромпропана:
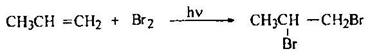
Механизм реакции
Стадия 1 – гомолиз молекулы брома:
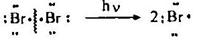
Стадия 2 – образование бромалкильного радикала:
Стадия 3 – образование конечного продукта, продолжение цепи:

Активность галогенов в подобных реакциях соответствует ряду:
Cl2 > Br2 > I2, что объясняется соответствующей активностью атомов галогенов.
Йод к алкенам по радикальному механизму практически не присоединяется из-за низкой активности атомарного йода. Напротив, из-за высокой активности атомарного хлора, хлор не дает длинных цепей.
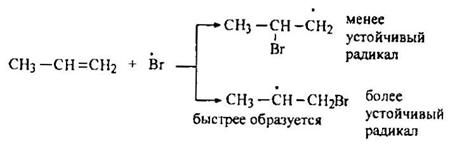
Гидробромирование.
Несимметричные алкены присоединяют HBr в присутствии пероксидов (или других инициаторов свободно-радикального процесса) против правила Марковникова (эффект Хараша):
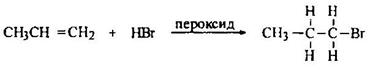
Объяснению этому факту дает механизм реакции. Поскольку пероксид способствует гомолитическому разрыву связи H-Br, реакция протекает по радикальному цепному механизму.
Стадия 1 – разложение пероксида:
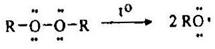
Стадия 2 – инициирование цепи:

Стадия 3 – образование бромалкильного радикала:
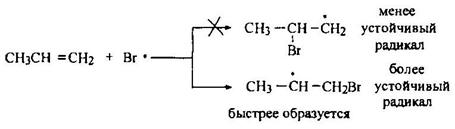
Стадия 4 – образование продукта, продолжение цепи:
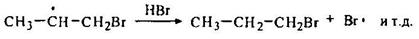
HCl и HI крайне малоактивны в радикальном присоединении к алкенам в указанных условиях. Связь H-Cl оказывается слишком прочной к гомолитическому разрыву. Напротив, молекула HI легко образует атомарный йод, который, однако, является малореакционноспособным.
 2018-02-14
2018-02-14 5380
5380
