Основная статья: Хромосомные болезни
Нормальные кариотипы человека — 46,XX (женский) и 46,XY (мужской). Нарушения нормального кариотипа у человека возникают на ранних стадиях развития организма: в случае, если такое нарушение возникает при гаметогенезе, в котором продуцируются половые клетки родителей, кариотип зиготы, образовавшейся при их слиянии, также оказывается нарушенным. При дальнейшем делении такой зиготы все клетки эмбриона и развившегося из него организма обладают одинаковым аномальным кариотипом.
Однако нарушения кариотипа могут возникнуть и на ранних стадиях дробления зиготы, развившийся из такой зиготы организм содержит несколько линий клеток (клеточных клонов) с различными кариотипами, такая множественность кариотипов всего организма или отдельных его органов именуется мозаицизмом.
Как правило, нарушения кариотипа у человека сопровождаются множественными пороками развития; большинство таких аномалий несовместимо с жизнью и приводят к самопроизвольнымабортам на ранних стадиях беременности. Однако достаточно большое число плодов (~2.5 %[ источник не указан 1068 дней ]) с аномальными кариотипами донашивается до окончания беременности.
17) Строение белка. Рибосомы. Трансляция.
Белки́ (протеи́ны, полипепти́ды [1]) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью альфа-аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс.
Функции белков в клетках живых организмов более разнообразны, чем функции других биополимеров — полисахаридов и ДНК. Так, белки-ферментыкатализируют протекание биохимических реакций и играют важную роль в обмене веществ. Некоторые белки выполняют структурную или механическую функцию, образуя цитоскелет, поддерживающий форму клеток. Также белки играют важную роль в сигнальных системах клеток, прииммунном ответе и в клеточном цикле.
Белки — важная часть питания животных и человека (основные источники: мясо, птица, рыба, молоко, орехи, бобовые, зерновые; в меньшей степени: овощи, фрукты, ягоды и грибы), поскольку в их организме не могут синтезироваться все необходимые аминокислоты и часть из них поступает с белковой пищей. В процессе пищеварения ферменты разрушают потреблённые белки до аминокислот, которые используются прибиосинтезе белков организма или подвергаются дальнейшему распаду для получения энергии.
Определение аминокислотной последовательности первого белка — инсулина — методом секвенирования белков принесло Фредерику СенгеруНобелевскую премию по химии в 1958 году. Первые трёхмерные структуры белков гемоглобина и миоглобина были получены методом дифракциирентгеновских лучей, соответственно, Максом Перуцем и Джоном Кендрю в 1958 году[2][3], за что в 1962 году они получили Нобелевскую премию по химии.
Структура белка
Молекулы белков представляют собой линейные полимеры, состоящие из α-L-аминокислот (которые являютсямономерами) и, в некоторых случаях, из модифицированных основных аминокислот (правда, модификациипроисходят уже после синтеза белка на рибосоме). Для обозначения аминокислот в научной литературе используются одно- или трёхбуквенные сокращения. Хотя на первый взгляд может показаться, что использование в большинстве белков «всего» 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: для цепочки всего из 5 аминокислот оно составляет уже более 3 миллионов, а цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10130вариантах. Белки длиной от 2 до нескольких десятков аминокислотных остатков часто называют пептидами, при большей степени полимеризации — белками, хотя это деление весьма условно.
При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-COOH) другой аминокислоты образуются пептидные связи. Концы белка называют C- и N-концом (в зависимости от того, какая из групп концевой аминокислоты свободна: -COOH или -NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белка даётся путём перечисления аминокислотных остатков начиная с N-конца.
Последовательность аминокислот в белке соответствует информации, содержащейся в гене данного белка. Эта информация представлена в виде последовательности нуклеотидов, причём одной аминокислоте соответствует в ДНК последовательность из трёх нуклеотидов — так называемый триплет или кодон. То, какая аминокислота соответствует данному кодону в мРНК, определяетсягенетическим кодом, который может несколько различаться у разных организмов. Синтез белков на рибосомах происходит, как правило, из 20 аминокислот, называемых стандартными[12]. Триплетов, которыми закодированы аминокислоты в ДНК, у разных организмов от 61 до 63 (то есть из числа возможных триплетов (4³ = 64) вычтено число стоп-кодонов (1—3)). Поэтому появляется возможность, что большинство аминокислот может быть закодировано разными триплетами. То есть, генетический код может являться избыточным или, иначе, вырожденным. Это было окончательно доказано в эксперименте при анализе мутаций[13]. Генетический код, кодирующий различные аминокислоты, имеет разную степень вырожденности (кодируются от 1 до 6 кодонами), это зависит от частоты встречаемости данной аминокислоты в белках, за исключением аргинина[13]. Часто основание в третьем положении оказывается несущественным для специфичности, то есть одна аминокислота может быть представлена четырьмя кодонами, различающимися только третьим основанием. Иногда различие состоит в предпочтении пурина пиримидину. Это называют вырожденностью третьего основания.
Такой трёхкодонный код сложился эволюционно рано. Но существование различий в некоторых организмах, появившихся на разных эволюционных стадиях, указывает на то, что он был не всегда таким.
Согласно некоторым моделям, сначала код существовал в примитивном виде, когда малое число кодонов обозначало сравнительно небольшое число аминокислот. Более точное значение кодонов и большее число аминокислот могли быть введены позже. Сначала только первые два из трёх оснований могли быть использованы для узнавания [что зависит от структуры тРНК].
— Б. Льюин. Гены, М.: 1987, с. 62.
Гомологичные белки (предположительно имеющие общее эволюционное происхождение и нередко выполняющие одну и ту же функцию), например, гемоглобины разных организмов, имеют во многих местах цепи идентичные, консервативные остатки аминокислот. В других местах находятся различные аминокислотные остатки, называемые вариабельными. По степени гомологии (сходства аминокислотной последовательности) возможна оценка эволюционного расстояния между таксонами, к которым принадлежат сравниваемые организмы.
Уровни организации
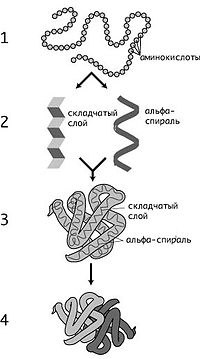

Уровни структуры белков: 1 — первичная, 2 — вторичная, 3 — третичная, 4 — четвертичная
Кроме последовательности аминокислот полипептида (первичной структуры), крайне важна третичная структура белка, которая формируется в процессефолдинга (от англ. folding, «сворачивание»). Третичная структура формируется в результате взаимодействия структур более низких уровней. Выделяют четыре уровня структуры белка[14]:
§ Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являютсяконсервативные мотивы — сочетания аминокислот, играющих ключевую роль в функциях белка. Консервативные мотивы сохраняются в процессеэволюции видов, по ним часто удаётся предсказать функцию неизвестного белка.
§ Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями. Ниже приведены самые распространённые типы вторичной структуры белков:
§ α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[15] (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцинамогут стерически мешать образованию спирали, остатки пролина вызывают изгиб цепи и тоже нарушают α-спирали.
§ β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток[15]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин.
§ π-спирали;
§ 310-спирали;
§ неупорядоченные фрагменты.
§ Третичная структура — пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
§ ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
§ ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
§ водородные связи;
§ гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
§ Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул.
Окружение белков
Разные способы изображения трёхмерной структуры белка на примере фермента триозофосфатизомеразы. Слева — «палочковая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине изображены структурные мотивы, α-спирали и β-листы. Справа изображена контактная поверхность белка, построенная с учётомван-дер-ваальсовых радиусов атомов; цветами показаны особенности активности участков
По общему типу строения белки можно разбить на три группы:
1. Фибриллярные белки — образуют полимеры, их структура обычно высокорегулярна и поддерживается, в основном, взаимодействиями между разными цепями. Они образуют микрофиламенты, микротрубочки, фибриллы, поддерживают структуру клеток и тканей. К фибриллярным белкам относятся кератин и коллаген.
2. Глобулярные белки — водорастворимы, общая форма молекулы более или менее сферическая. Среди глобулярных и фибриллярных белков выделяют подгруппы. Например, изображённый на картинке справа глобулярный белок,триозофосфатизомераза, состоит из восьми α-спиралей, расположенных на внешней поверхности структуры и восьми параллельных β-слоёв внутри структуры. Белки с подобным трёхмерным строением называются αβ-баррелы (от англ. barrel — бочка)[16].
3. Мембранные белки — имеют пересекающие клеточную мембрану домены, но части их выступают из мембраны в межклеточное окружение и цитоплазму клетки. Мембранные белки выполняют функцию рецепторов, то есть осуществляют передачу сигналов, а также обеспечивают трансмембранный транспорт различных веществ. Белки-транспортёры специфичны, каждый из них пропускает через мембрану только определённые молекулы или определённый тип сигнала.
 2018-02-14
2018-02-14 941
941








