По теореме о равнораспределении энергии по степеням свободы на одну степень свободы приходится в среднем энергия, равная 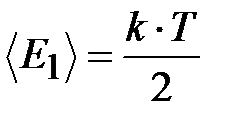 . У каждой частицы кристалла i =3 колебательных степени свободы. При колебаниях имеют место два вида энергии: кинетическая и потенциальная; поэтому на каждую колебательную степени свободы приходится двойная порция энергии
. У каждой частицы кристалла i =3 колебательных степени свободы. При колебаниях имеют место два вида энергии: кинетическая и потенциальная; поэтому на каждую колебательную степени свободы приходится двойная порция энергии 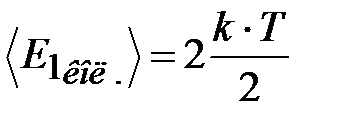 . Энергия одного атома (иона):
. Энергия одного атома (иона):
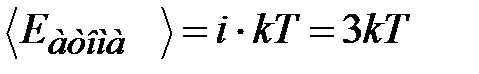 .
.
Внутренняя энергия одного моля кристалла, состоящего из N А частиц (химически простое тело), равна:
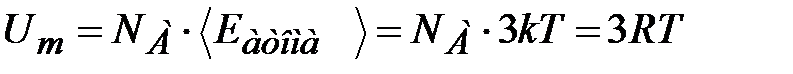 .
.
Объём твёрдых тел при нагревании почти не меняется, поэтому 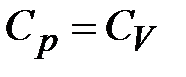 . Молярная теплоёмкость
. Молярная теплоёмкость
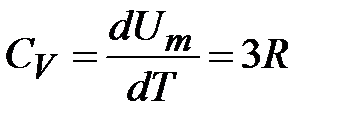 . (9.40)
. (9.40)
Таким образом, по классической теории теплоёмкостей, молярная теплоёмкость всех химически простых тел одинакова, не зависит от температуры и равна
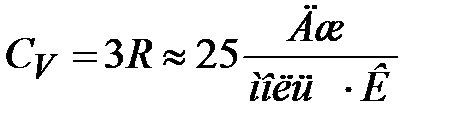 .
.
Это – закон Дюлонга и Пти.
Для химических соединений число частиц в одном моле вещества в z раз больше (z – число атомов в молекуле). Например, в моле NaCl содержится N А атомов натрия и N А атомов хлора; z =2. Тогда
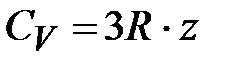 .
.
Экпериментальные данные согласуются с этим законом только при достаточно высокой температуре (рис.9.25), она – своя для каждого вещества. Например, при комнатной температуре теплоёмкость алмаза равна 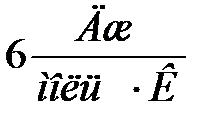 и достигает значения
и достигает значения 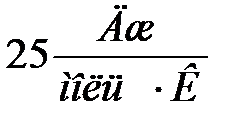 только при температуре больше 10000С.
только при температуре больше 10000С.
У металлов вклад в теплоёмкость вносит также и электронный газ.
| Рис.9.25 |
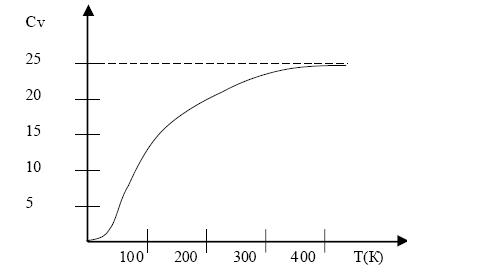
Для более правильного описания теплоёмкости классическая статистика не годится; нужно использовать квантовые статистики. О них и о квантовых теориях теплоёмкости Эйнштейна и Дебая – в третьей части курса физики.
 2018-02-14
2018-02-14 465
465







