Основные понятия
ИММУНИТЕТ (IMMUNITY) - это общебиологический феномен, суть которого заключается в долговременном самоподдержании внутри отдельного организма баланса между генетически "своим" и "несвоим" в условиях чужеродного окружения. ИММУННАЯ СИСТЕМА (IMMUNE SYSTEM) специализируется в реализации механизмов данного феномена. Чтобы понять основы науки ИММУНОЛОГИИ (IMMUNOLOGY), необходимо изучить защитные механизмы, направленные на устранение "несвоего", и регуляторные процессы, которые формируют внутренний гомеостаз "своего" в организме. Иммунитет может быть врождённым и адаптивным (приобретённым, специфическим). Отказ одного или нескольких компонентов иммунной системы может приводить к развитию иммунодефицитов и утрате способности к защите от инфекции. Расстройства регуляции в функционировании данной системы способствуют развитию аутоиммунных болезней, аллергий и росту опухолей. Важность самого существования иммунной системы иллюстрируется появлением в последние 20 лет новой болезни - СПИД (синдрома приобретённого иммунодефицита), при которой наблюдаются все возможные варианты нарушений со стороны иммунной системы.
АНТИГЕН (АNTIGEN) является макромолекулой, содержащей чужеродную или собственную информацию, которая представляет собой основу для запуска специфического иммунного ответа; с другой стороны, следует иметь в виду, что любой антиген часто служит для исследователей иммунобиологическим маркёром. Общее число различных антигенов оценивается в число 1018. Молекула полного антигена состоит из информационной части (низкомолекулярные антигенные детерминанты, эпитопы, гаптены) и несущей части (макромолекулярный белок). Изолированная информационная часть сама по себе не является иммуногенной, т.е. не способна индуцировать иммунный ответ.
АНТИТЕЛО (ANTIBODY) или ИММУНОГЛОБУЛИН (IMMUNOGLOBULIN) - это один из типов молекул иммунной системы. Антитела и антигенраспознающие рецепторы могут связывать соответствующие антигены.
ЛИМФОЦИТЫ (LYMPHOCYTES) являются главными клетками иммунной системы. По-существу, иммунная система - это иерархическая совокупность лимфоидных клеток (1013). Существуют T-, B- и NK- лимфоциты. Т-клетки дифференцируются в тимусе и играют ключевую роль во всех направлениях специфического иммунного ответа. В-лимфоциты дифференцируются в костном мозге, являются предшественниками плазмоцитов - антителопродуцентов. NK-клетки (естественные киллеры) участвуют в неспецифической цитотоксичности по отношению к внутриклеточно расположенным патогенам. Остальные клетки (макрофаги, дендритные клетки, нейтрофилы, эозинофилы, тучные клетки и др.) также участвуют во многих иммунных процессах, но их участие скорее опосредованное, т.е. они привлекаются лимфоцитами для реализации функций иммунной (лимфоидной) системы..
Стратегической функцией иммунной системы является реализация генетической программы индивидуального развития организма от рождения до смерти в условиях чужеродного окружения.
Тактические функции:
1. Защита от "несвоего" (инфекции, трансплантата).
2. Элиминация модифицированного "своего" (опухолей, повреждённых, стареющих клеток).
3. Регуляция роста и развития клеток и тканей.
Главными партнёрами иммунной системы являются центральная нервная система, эндокринная система и печень, которые наиболее важны для обеспечения регуляции гомеостаза.
Функциональная организация иммунной системы может быть рассмотрена на органном, клеточном и молекулярном уровнях. Существует два типа органов иммунной системы, центральные (или первичные) и периферические (или вторичные). КОСТНЫЙ МОЗГ (bone marrow) - центральный орган, в котором рождаются все клетки иммунной системы и созревают В-лимфоциты (В-лимфопоэз или В-коммитмент). ТИМУС (thymus)- центральный орган, в котором дифференцируются Т-лимфоциты (Т-лимфопоэз или Т-коммитмент) и который также является общекоординирующим для всей иммунной системы.
В периферических органах происходит встреча лимфоцитов с антигенами и их специфическая антигензависимая дифференцировка. Этот процесс называется иммунным ответом (immune response), сутью которого является создание целой "армии" специфически реагирующих лимфоцитов и специфических антител, которые осуществляют эффекторные реакции по уничтожению данного конкретного антигена. Существуют Т-клеточный и В-клеточный (гуморальный) пути иммунного ответа.
К периферическим органам относятся:
q Лимфатические узлы, лимфатические протоки и селезёнка;
q Лимфоидная ткань, ассоциированная со слизистыми оболочками, mucosae (Mucous-Associated Lymphoid Tissue - МАLT), которая расположена на пяти уровнях. Первые два уровня - евстахиева труба (Tube-Associated Lymphoid Tissue - ТАLТ) и носоглотка (Nasal-Associated Lymphoid Tissue - NALT) - представлены различными миндалинами; следующий уровень - бронхи (Bronchus-Associated Lymphoid Tissue - BALT) и грудные железы (у женщин); четвёртый уровень - верхние отделы желодочно-кишечного тракта (Gut-Associated Lymphoid Tissue - GАLТ) - содержат лимфоидную ткань желудка и пейеровы бляшки тонкого кишечника, пятый уровень - это нижние отделы желудочно-кишечного тракта и мочеполовая система - аппендикс, солитарные фолликулы толстого кишечника и лимфоидная ткань мочеполовой системы;
q Лимфоидная ткань, ассоциированная с кожей (Skin-Associated Lymphoid Tissue - SАLТ).
Большой вклад в развитие иммунологии от Edward Jenner до наших дней внесли такие учёные как L.Pasteur, И.И.Мечников, P.Ehrlich, Н.Ф.Гамалея, F.McFarlane Burnet, N.K.Jerne, Р.В.Петров, Н.В.Васильев, S.Tonegawa и другие.
Клетки иммунной системы
Все клетки, относящиеся к иммунной системе и привлекаемые ею для обеспечения эффекторных реакций, в функциональном отношении можно разделить на четыре группы:
1. АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ (ANTIGEN-PRESENTING CELLS):
макрофаги, дендритные клетки типов 1 и 2, В-лимфоциты;
2. РЕГУЛЯТОРНЫЕ КЛЕТКИ (REGULATORY CELLS):
T-индукторы, Т-хелперы типов 1, 2 и 3, Т-регуляторы типа 1;
3. ЭФФЕКТОРНЫЕ КЛЕТКИ (EFFECTOR CELLS):
плазматические клетки (дифференцирующиеся из В-лимфоцитов);
цитотоксические Т-клетки с фенотипом CD8+ (или T-киллеры);
эффекторные Т-клетки воспаления с фенотипом CD4+ (или Т-лимфоциты, ответственные за гиперчувствительность замедленного типа);
нейтрофилы, эозинофилы, базофилы, тучные клетки, натуральные киллеры (NK-клетки), макрофаги.
4. КЛЕТКИ ПАМЯТИ (MEMORY CELLS):
Т-клетки памяти с фенотипом CD8+; Т-клетки памяти с фенотипом CD4+;
долгоживующие плазматические клетки; В-клетки памяти.
Номенклатура CD ("Сluster of Differentiation"), основана на моноклональной технологии, которая была разработана Нобелевскими лауреатами (1984)G.J.F. Kohler (Швейцария) и C.Milstein (Аргентина/Великобритания), позволяет идентифицировать клетки относительно их происхождения, стадии дифференцировки, функционального состояния и т.д. (см. Табл. 1). Данная технология, без сомнения, оказалась революционной в иммунологических и смежных областях исследований.
Taблица 1
ГЛАВНЫЕ ИДЕНТИФИКАЦИОННЫЕ CD-МАРКЁРЫ
КЛЕТОК ИММУННОЙ СИСТЕМЫ
| Обозначение кластера | Клетки |
| CD10 | Лимфоидная стволовая клетка |
| CD3 | T-лимфоцит |
| CD4 | Т-лимфоцит-хелпер/Т-индуктор |
| CD8 | Цитотоксический T-лимфоцит |
| CD19, СD72, CD79a/b и др. | B-лимфоцит |
| CD16/CD56 | Натуральный киллер (NK-клетка) |
| CD14/CD64 | Moноцит/макрофаг |
Лимфоциты как главные клетки иммунной системы имеют отличительные особенности:
1. Постоянная "патрульная" рециркуляция по кровотоку, лимфотоку, межтканевым пространствам и секретам.
2. Способность распознавать, т.е. взаимодействовать со "своим" и "несвоим" по принципу "лиганд - рецептор".
3. Клональная организация (McF. Burnet) и способность формировать сетевые элементы (N.K. Jerne).
4. Способность к непрерывным реаранжировкам в своём геноме в любом возрасте в связи с потребностями формирования специфического ответа на патоген.
5. Умение запоминать о факте встречи с каким-либо антигеном и обеспечивать в будущем экспрессный высокоэффективный ответ на него.
КЛОН (a clone) - это группа лимфоцитов, коммитированная к определённому антигену. До встречи с этим антигеном каждый лимфоцит клона называют наивным. По-видимому, в человеческом организме исходно существуют десятки миллионов клонов Т- и В-лимфоцитов. После встречи с соответствующим антигеном и в результате иммунного ответа коммитированный лимфоцит становится праймированным.
1.3. Молекулы иммунной системы
Для осуществления необходимых функций клетки иммунной системы имеют сложную молекулярную организацию своих рецепторов и способны к выработке целого ряда молекул.
1. АНТИГЕНПРЕДСТАВЛЯЮЩИЕ, АНТИГЕНРАСПОЗНАЮЩИЕ И АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ. Набор этих молекул уникален для каждого организма, для каждого лимфоцитраного клона и для каждого специфического иммунного ответа. К ним относятся:
· антигенраспознающие иммуноглобулиновые рецепторы В-клеток (B cellular receptors - BCR);
· свободные иммуноглобулины: IgM, IgG, IgA, IgE, IgD;
· антигенраспознающие рецепторы Т-клеток (T cellular receptors - TCR);
· антигенпредставляющие молекулы: лейкоцитарные антигены главного комплекса гистосовместимости (Human leukocyte antigens - HLA I и II) и молекулы CD1 (a, b, c, d, e).
2. АДГЕЗИВНЫЕ МОЛЕКУЛЫ опосредуют взаимодействия между клетками и лигандами при непосредственном контакте:
· суперсемейство иммуноглобулинподобных молекул;
· интегрины;
· селектины;
· муцины (муциноподобные васкулярные аддрессины);
· суперсемейство рецепторов к факторам некроза опухоли и фактору роста нервов - TNF/NGF (или молекулы, опосредующие апоптоз);
· линк-семейство (компоненты экстрацеллюлярного матрикса).
3. ИММУНОЦИТОКИНЫ являются гормонами иммунной системы, действующими чаще с пара- и аутокринным, реже - с эндокринным эффектами:
· интерлейкины (Interleukins - ILs);
· колониестимулирующие факторы (Colony-stimulating factors - CSFs);
· интерфероны (Interferons - IFNs);
· факторы некроза опухоли (Tumour-necrosis factors - TNFs);
· хемокины (Chemokines) и др.
4. СБОРНАЯ ГРУППА РАЗЛИЧНЫХ МЕДИАТОРОВ ИММУННОГО ВОСПАЛЕНИЯ включает белки комплемента, "острой фазы", простаноиды и лейкотриены, протеолитические ферменты и др.
 Иммуноглобулины M, G, A, E и D являются эффекторными молекулами гуморального иммунного ответа. Молекула иммуноглобулина является гликопротеином; белковые цепи включают сотни aминокислотных последовательностей; углеводный компонент составляет 2-12 %. Молекула IgG (см. Рис. 1) состоит из двух идентичных лёгких (light - L) и двух
Иммуноглобулины M, G, A, E и D являются эффекторными молекулами гуморального иммунного ответа. Молекула иммуноглобулина является гликопротеином; белковые цепи включают сотни aминокислотных последовательностей; углеводный компонент составляет 2-12 %. Молекула IgG (см. Рис. 1) состоит из двух идентичных лёгких (light - L) и двух 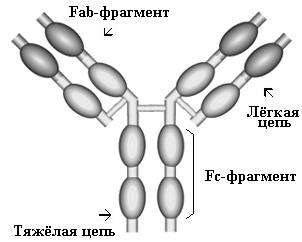 идентичных тяжёлых (heavy - H) цепей (chains). Лёгкие цепи бывают двух типов: (легкие- λ и χ, тяжёлые - пяти (α, γ, δ, ε, μ) Лёгкие и тяжёлые цепи содержат повторяющиеся гомологичные последовательности и образуют своеобразные клубки (домены). Существуют константные (constant) (CL, CH1, CH2 и CH3) и вариабельные (variable) домены (VL и VH). Гипервариабельные области вариабельных доменов формируют антигенсвязывающие сайты или активные центры. Молекула иммуноглобулина может быть также разделена на Fc-фрагмент (a fragment crystalline), который ответственен за неспецифическую эффекторную активность, и2 Fab-фрагмента (fragment antigen-binding), которые содержат антигенсвязывающие сайты. Химическая природа антител была подробно изучена Нобелевскими лауреатами (1972) G.M.Edelman (США) и R.R.Porter (Великобритания).
идентичных тяжёлых (heavy - H) цепей (chains). Лёгкие цепи бывают двух типов: (легкие- λ и χ, тяжёлые - пяти (α, γ, δ, ε, μ) Лёгкие и тяжёлые цепи содержат повторяющиеся гомологичные последовательности и образуют своеобразные клубки (домены). Существуют константные (constant) (CL, CH1, CH2 и CH3) и вариабельные (variable) домены (VL и VH). Гипервариабельные области вариабельных доменов формируют антигенсвязывающие сайты или активные центры. Молекула иммуноглобулина может быть также разделена на Fc-фрагмент (a fragment crystalline), который ответственен за неспецифическую эффекторную активность, и2 Fab-фрагмента (fragment antigen-binding), которые содержат антигенсвязывающие сайты. Химическая природа антител была подробно изучена Нобелевскими лауреатами (1972) G.M.Edelman (США) и R.R.Porter (Великобритания).
Каждый В-лимфоцит экспрессирует В-клеточный антигенраспознающий рецептор (an antigen-recognizing receptor - BCR), который состоит из мономерных имуноглобулинов IgM и IgD, имеет клональную гетерогенность и ассоциирован с молекулами CD79a и CD79b, необходимыми для проведения сигнала внутрь клетки. Наряду с этими молекулами, имеется также корецепторный комплекс (CD19, CD21(CR2), CD81), предназначенный для распознавания HLA II.
Каждый Т-лимфоцит экспрессирует Т-клеточный антигенраспознающий рецептор (an antigen-recognizing receptor - abTCR), который состоит из двух цепей, a и b, и имеет один из корецепторов - CD4 (у Т-хелперов) или CD8 (у цитотоксических Т-лимфоцитов). Эти инвариантные корецепторы CD4 и CD8 необходимы для распознавания соответственно HLA II или HLA I. Каждая цепь TCR подобно молекуле иммуноглобулина имеет вариабельный и константный домены, что обеспечивает клональную гетерогенность антигенраспознающих рецепторов. Ещё одна молекула (CD3) тесно ассоциирована c TCR и служит для проведения сигнала внутрь клетки. CD3 состоит из 5 инвариантных белков (e,g,d,x,h). Другой тип антигенраспознающего рецептора, gdTCR, экспрессируется на небольшой субпопуляции Т-клеток. Эти gdT-клетки, роль которых пока до конца не исследована, по-видимому, функционируют подобно NK-клеткам, однако они тоже имеют определённую клональную гетерогенность.
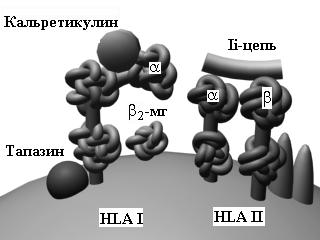
Молекулы гистосовместимости были открыты Нобелевскими лауреатами (1980) B.Benacerraf (США), J.Dausset (Франция) и G.D.Snell (США). Эти молекулы играют решающую роль во многих иммунных процессах, включая загрузку антигенных пептидов и их презентацию. Молекулы HLA разделяются на класс I (A, B, C, E, F, G) и класс II (DR, DP, DQ) в зависимости от их структуры и функции. Экспрессия HLA I имеет место почти на всех клетках (за исключением синцитиотрофобласта), выполняя функцию взаимной информации клеток внутри организма об аутологичности; экспрессия HLA II наблюдается почти исключительно на клетках иммунной системы: B-лимфоцитах, макрофагах, эндотелиоцитах, активированных Т-клетках и др.
|
Не-HLA молекулы CD1 (a, b, c, d и e), которые состоят по аналогии с HLA I из a-цепи и b2-микроглобулина, также вовлечены в процессы загрузки антигенов, но небелковой природы (фосфолипиды, липополисахариды).
Имеется связь между наследованием некоторых генов HLA и высоким риском развития определённых болезней. Например, более 90 % пациентов с анкилозирующим спондилоартритом, тяжёлой аутоиммунной патологией позвоночника, имеют ген HLA-B27.
Поскольку HLA определяет гистосовместимость, необходимо, чтобы у донора и реципиента при трасплантации органа или ткани было соответствие по HLA. Карта пациента по HLA называется "full house" ("полный дом") и включает данные относительно двух аллелей каждого вида молекул (например, HLA-A, HLA-B, HLA-DR и др.). Сенсибилизация белками HLA в прошлом (при гемотрансфузиях, транплантациях или беременности) может приводить к острому отторжению пересаживаемого трансплантата или тромбоцитопении при переливании крови, поэтому необходимо обязательное тестирование на наличие антител против HLA. Типирование HLA может cлужить дополнительным критерием для диагностики таких болезней как анкилозируюзий спондилоартрит, диабет, целиакия, гемохроматоз, псориаз и нарколепсия, при которых известна высокая степень связи с определёнными гаплотипами HLA.
Иммунные ответы - это процесс взаимодействия клеток иммунной системы, который индуцируется антигеном и приводит к образованию эффекторных клеток и молекул, которые уничтожают данный антиген. Иммунные ответы – это всегда специфический, но не изолированный процесс, который протекает только в периферических органах иммунной системы. Как правило, он сопровождается такими реакциями естественного иммунитета как фагоцитоз, активация комплемента, NK-клеток и т.д.
В начальных стадиях иммунного ответа участвуют, по крайней мере, три вида клеток: макрофаг (а также дендритная клетка), Т- и В-лимфоцит. В целом, все клетки, вовлечённые в этот процесс, могут быть разделены, как указывалось выше, на антигенпредставляющие, регуляторные, эффекторные и клетки памяти. Имеется четыре варианта иммунных ответов:
1. T-клеточный ответ с образованием Т-клеток воспаления;
2. Т-клеточный ответ с образование цитоткосических Т-клеток;
3. Простой В-клеточный (гуморальный) ответ с синтезом IgM;
4. Развёрнутый В-клеточный (гуморальный) ответ
c последовательным образованием антител разных классов.
Т-клеточные ответы регулируются Т-хелперами типа 1 и приводят к формированию
1) эффекторных CD4+ T-клеток воспаления
2) цитотоксических CD8+ T-лимфоцитов, а также соответствующих им Т-клеток памяти.
При простом гуморальном ответе образуется только IgM без формирования иммунной памяти. Развёрнутый гуморальный ответ регулируется Т-хелперами типа 2 и заканчивается образованием плазматических клеток (продуцентов антител классов M, G, A и E) и В-лимфоцитов памяти. Переключение на синтез некоторых изотипов антител частично контролируется Т-хелперами типа1. За исключением скрытого индуктивного периода иммунные ответы в среднем продолжаются около 3 недель с максимальным напряжением на 1-й неделе.
Можно выделить несколько основных стадий иммунных ответов:
· Эндоцитоз антигена, его процессинг и загрузка на молекулы HLA I или II для презентации лимфоцитам.
· Распознавание комплекса антигенный пептид/HLA I или II и других стимулов.
· Сигнальная трансдукция и активация клеточного клона.
· Клональная экспансия или пролиферация.
· Созревание эффекторных клеток и клеток памяти.
· Эффекторная активность.
Антигенпредставляющая клетка (макрофаг, дендритная клетка или В-лимфоцит) сталкивается с нативным антигеном и эндоцитирует его. Макрофаги фагоцитируют, главным образом, патогены, для которых характерно внутриклеточное паразитирование (вирусы, бактерии, грибы, простейшие и др.); дендритные клетки пиноцитируют вирусы; В-клетки интернализируют различные токсины. Следующее событие, процессинг (processing), представляет собой ферментативный катализ макромолекулы антигена внутри антигенпредставляющей клетки. В результате процессинга происходит высвобождение доминирующей антигенной детерминанты (иммуно-активного пептида), который загружается на желобки собственных молекул HLA I/II, выводится на поверхность клетки для представления (presentation) лимфоцитам. В зависимости от происхождения антигена выделяют два пути процессинга.
Экзогенные антигены презентируются в комплексе с молекуламиHLA II наивным CD4+ T-клеткам (путь, опосредуемый HLA II). Cначала эти антигены эндоцитируются и фрагментируются с помощью протеолитических ферментов в эндосомах (лизосомах). В то же самое время, молекулы HLA II, связанные с шаперонами (калнексином и инвариантной цепью Ii), синтезируются и собираются в эндоплазматическом ретикулуме. Ii-цепь необходима для защиты желобка молекулы HLA вплоть то того момента, пока сюда не будет загружен антигенный пептид. Затем комплекс HLA II/Ii-цепь транспортируется через аппарат Гольджи в эндосомы, где Ii-цепь теряется, а роль по защите желобка начинают выполнять дополнительные молекулы HLA-DM и, вероятно, HLA-DO. Наконец, антигенный пептид загружается на желобок молекулы HLA II, и этот комплекс эксспрессируется на поверхности клетки.
Эндогенные или внутриклеточно расположенные антигены микробного происхождения загружаются на молекулы HLA I (путь, опосредуемый HLA I) для представления наивным CD8+ T-клеткам. Сначала, в отличие от экзогенных антигенов, такие цитоплазматические антигены перемещаются в цитозоль, где они расщепляются в крупном протеолитическом комплексе - протеасоме. После этого антигенный пептид транспортируется через "туннель" молекул TAP-1/TAP-2 в эндоплазматический ретикулум. Одновременно здесь происходит сборка молекулы HLA I, желобок которой (по аналогии с Ii-цепью у HLA II) находится "под защитой" шаперонов (сначала калнексина, затем кальретикулина), а укладка всей молекулы HLA I в последующем стабилизируется дополнительными молекулами (тапазином и др.). После загрузки антигенного пептида на желобок HLA I этот комплекс транспортируется на поверхность клетки.
Небелковые антигены, вероятно,загружаются на не-HLA антигенпредставляющие молекулы CD1.
В целом, макрофаги и В-клетки вовлечены соответственно в Т-клеточный или гуморальный иммунный ответ по пути, опосредованному HLA II, а дендритные клетки двух типов способны к перекрёстной презентации. Дендритная клетка типа 1 осуществляет процессинг эндогенных антигенов по пути с HLA I для запуска Т-клеточного ответа, а дендритная клетка типа 2 процессирует экзогенные антигены по пути с HLA II и включает В-клеточный ответ.
Распознавание (recognition) протекает в течение нескольких часов. Однако при нарушениях клеточной миграции и межклеточных взаимодействий оно может быть более длительным. Возможно, это приводит к замедлению всего иммунного ответа на патоген. Клиническими проявлениями этой стадии являются повышение температуры тела, мышечная слабость, снижение аппетита и сонливость. По большей части они обусловлены системными эффектами цитокинов, о чём будет более подробно рассказано далее.
Для того, чтобы мог стартовать специфический иммунный ответ на конкретный антиген, необходимо, чтобы Т- и В-лимфоциты соответствующего клона встретились с антигенпредставляющей клеткой. Некоторые антигены бактерий (T-независимые антигены) распознаются с помощью BCR B-клеток и не требуют помощи со стороны Т-хелперов. Большинство нативных антигенов (так называемых T-зависимых антигенов) распознаётся по "полной программе" наивными CD4+ T-хелперами типа 1 и CD8+ T-клетками (для включения Т-клеточного ответа или пути Т-хелперов 1), а также нaивными CD4+ T-хелперами типа 2 (для включения гуморального ответа или пути Т-хелперов 2). Интересно, что для прайминга CD8+ Т-клеток необходимо участие CD4+ T-хелперов 1.
Во время распознавания лимфоциты воспринимают три типа обязательных сигналов, один специфический и два неспецифических:
1. Aнтигенный пептид/HLA I или II.
2. Цитокины.
3. Костимулирующие молекулы.
Aнтигенный пептид, загружаемый на HLA I или II в результате процессинга, служит специфическим сигналом. Это одновременное "двойное" распознавание "своего" (белков HLA) и "несвоего" (чужого антигена) было открыто Нобелевскими лауреатами (1996) P.C.Doherty (Австралия, США) и R.M.Zinkernagel (Швейцария) и оказалось довольно универсальным явлением. Секретируемые цитокины и экспрессируемые костимулирующие молекулы являются двумя обязательными неспецифическими сигналами. Более того, для обеспечения надёжного физического контакта клеток необходим также взаимодействие таких адгезивных молекул как LFA-1, ICAM-1, ICAM-2, ICAM-3.
Цитокины играют одну из ключевых ролей в неспецифической регуляции иммунного ответа. Т- и В-лимфоциты получают цитокиновые сигналы от антигенпредставляющих клеток, NK-клеток, тучных клеток и др. Обратный сигнал от лимфоцитов, например, секретируемый IFNg, способствует реэкспрессии HLA I/II на антигенпредставляющих клетках. Цитокины, дуйствующие на ранних стадиях иммунного ответа, могут быть разделены на две группы в зависимости от его направления:
1. IL12, IL2, IL18, IFNg, TNFa/b (для пути Т-хелперов типа 1).
2. IL4 (для пути Т-хелперов типа 2).
Однако, на следующих стадиях иммунного ответа (клональная экспансия, созревание эффекторов, переключение синтеза изотипов антител) в процесс вовлекаются другие цитокины.
Костимулирующие молекулы также играют важную роль в неспецифической регуляции иммунного ответа (см. Табл. 2.).
Таблица 2
 2018-02-20
2018-02-20 4835
4835