При изучении равновесных и обратимых термодинамических процессов идеальных газов должны быть выявлены: во-первых, закономерность изменения основных параметров, характеризующих состояние рабочего тела; во-вторых, особенности реализации условий первого закона термодинамики.
В общем случае два любых параметра рабочего тела могут изменяться произвольно. Однако наибольший интерес представляют частные случаи. К числу частных термодинамических процессов относятся: изохорный, изобарный, изотермический, адиабатный, и политропный, который при определенных условиях может рассматриваться в качестве обобщенного по отношению ко всем выше перечисленным процессам.
Политропный процесс
Политропным процессом называется такой термодинамический процесс изменения состояния физической системы, при котором в течение всего процесса сохраняется постоянство теплоемкости.
Пусть С – теплоемкость политропного процесса, тогда используя выражения  или
или  ;
; 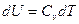 и
и  , получим уравнение первого закона термодинамики в виде:
, получим уравнение первого закона термодинамики в виде:
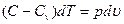 . (92)
. (92)
С учетом выражения 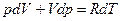 после ряда преобразований имеем:
после ряда преобразований имеем:
 , (93)
, (93)
откуда получим уравнение политропы:
 , (94)
, (94)
где  – показатель политропы.
– показатель политропы.
Согласно определению политропного процесса n может быть любым, но постоянным в некотором интервале числом, которое достаточно близко воспроизводило бы разнообразные встречающиеся в практике линии индикаторных диаграмм.
Очевидно, что при некоторых частных значениях n уравнение (94) должно превращаться в уравнения простейших термодинамических процессов.
Действительно, если в уравнении (94) n = 0, получим уравнение изобары:
 .
.
В этом случае (для изобарного процесса) уравнение первого закона термодинамики для изолированных систем будет совпадать с формулой (49).
При  получим уравнение изохоры:
получим уравнение изохоры:
 ,
,
поскольку величина  будет бесконечно мала по сравнению с объемом (
будет бесконечно мала по сравнению с объемом ( ), ею можно пренебречь, тогда:
), ею можно пренебречь, тогда:
 .
.
Из определения изохорного процесса очевидно, что работа в этом процессе не совершается, поскольку работа есть произведение  (работа всегда связана с изменением объема). Тогда уравнение первого закона термодинамики для изолированных систем(49) при изохорном процессе примет вид:
(работа всегда связана с изменением объема). Тогда уравнение первого закона термодинамики для изолированных систем(49) при изохорном процессе примет вид:
 . (95)
. (95)
Таким образом, подведенная к изолированной системе теплота в изохорном процессе расходуется только на изменение внутренней энергии системы.
При  получим уравнение изотермы:
получим уравнение изотермы:
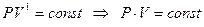 ,
,
но поскольку, согласно закону Бойля – Мариотта, если произведение давления и объема есть величина постоянная, то процесс – изотермический, тогда:
 .
.
В изотермическом процессе не происходит изменения внутренней энергии системы, поскольку температура постоянна. Тогда уравнение первого закона термодинамики для изолированных систем(49) при изотермическом процессе примет вид:
 . (96)
. (96)
Таким образом, подведенная к изолированной системе теплота в изотермическом процессе расходуется только на совершение системой внешней работы.
При  получим уравнение адиабаты:
получим уравнение адиабаты:
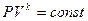 .
.
Показатель адиабаты 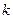 еще называют коэффициентом Пуассона. Величина этого показателя зависит от числа атомов в молекуле газа. При этом
еще называют коэффициентом Пуассона. Величина этого показателя зависит от числа атомов в молекуле газа. При этом 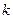 может принимать следующие значения:
может принимать следующие значения:
- для одноатомных газов (на самом деле состояние одноатомного газа не существует, оно введено для идеальных газов)
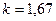 ;
; - для двухатомных газов (CO; О2; N2; Н2; F2; Cl2; воздух и др.)
 ;
; - для трехатомных газов (CO2; N2O; NO2 и др.)
 .
.
По определению, адиабатный процесс – это процесс, протекающий без теплообмена с окружающей средой, т.е.  . Тогда уравнение первого закона термодинамики для изолированных систем(49) при адиабатном процессе примет вид:
. Тогда уравнение первого закона термодинамики для изолированных систем(49) при адиабатном процессе примет вид:
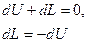 (97)
(97)
Таким образом, в адиабатном процессе работа может совершать за счет изменения (уменьшения) внутренней энергии системы в течение некоторого времени.
Таким образом политропный процесс является обобщающим по отношению к простейшим процессам. Для политропы справедливы соотношения:
 ;
; 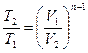 ;
; 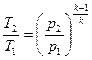 . (98)
. (98)
Работу политропного процесса можно определить по следующим формулам:
 ;
;  ;
;  ;
;
 ;
;  . (99)
. (99)
В PV -координатах работа l характеризуется площадью под процессом. Если 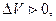 то и
то и  верно и обратное.
верно и обратное.
Теплоемкость политропного процесса можно определить по формуле:
 . (100)
. (100)
Таким образом, еще раз подтверждается, что теплоемкость идеального газа зависит от характера термодинамического процесса, что наглядно подтверждается на рисунке 7.

Рисунок 7 – Зависимость теплоемкости С процесса от показателя п политропы
На рисунке 8 представлены совмещенные диаграммы различнох термодинамических процессов.
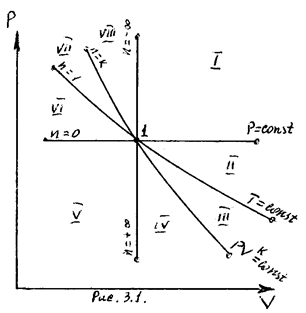
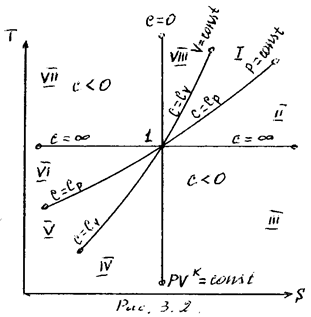
Рисунок 8 - Совмещенные диаграммы различных термодинамических
процессов в PV- и TS – координатах
Если в РV- и ТS – координатах выбрать некоторую произвольную точку 1 и провести из нее все рассмотренные выше термодинамические процессы, то все поле построенной таким образом диаграммы делится на 8 областей, характеризующихся определенными признаками. Так, все процессы слева от точки 1 на РV – диаграмме сопровождаются отрицательной работой. Все процессы справа от точки 1 на
TS – диаграмме происходят с подводом теплоты, слева – с отводом теплоты, вверх от изотермы – с увеличением внутренней энергии и энтальпии; вниз – с уменьшением. Области, выделенные на PV – диаграмме, соответствуют процессам с подводом теплоты, а на ТS – диаграмме – процессам с положительной теплоемкостью и т.д.
Для определения изменения энтропии в политропном процессе достаточно уравнение (100) подставить в выражение  , и с учетом того, что
, и с учетом того, что  получим:
получим:
 . (101)
. (101)
После интегрирования:
 . (102)
. (102)
С учетом выражений (98), можно записать:
 . (103)
. (103)
Изменения внутренней энергии и энтропии в политропном процессе определяются в ТS – координатах площадями соответственно под изохорным и изобарным процессами, происходящими в том же интервале температур  .
.
 2020-01-15
2020-01-15 163
163








