Количественной характеристикой процесса электролитической диссоциации является степень диссоциации.
Степенью диссоциации a называется отношение количества электролита, распавшегося на ионы (n), к общему количеству электролита (n0): 
Величина 𝛼 выражается в долях единицы или в % и зависит от природы электролита, растворителя, температуры, концентрации и состава раствора.
По степени диссоциации электролиты условно разделяют на сильные (a > 30%), средние (3% < a < 30%) и слабые (a < 3%).
К сильным электролитам относят:
1) некоторые неорганические кислоты (HCl, HBr, HI, HNO3, H2SO4, HClO4 и ряд других);
2) гидроксиды щелочных (Li, Na, K, Rb, Cs) и щелочноземельных (Ca, Sr, Ba) металлов;
3) почти все растворимые соли.
Слабыми электролитами являются также многие неорганические кислоты (HCN, H2S, H2CO3 и др.) и основания (NH3∙H2O).
На основании значений  и
и 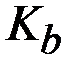 можно сделать заключение о сравнительной силе кислоты или основания: чем больше значение
можно сделать заключение о сравнительной силе кислоты или основания: чем больше значение 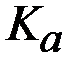 (
( ), тем сильнее кислота (основание);чем меньше значение
), тем сильнее кислота (основание);чем меньше значение  (
(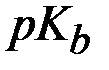 ), тем сильнее кислота (основание).
), тем сильнее кислота (основание).
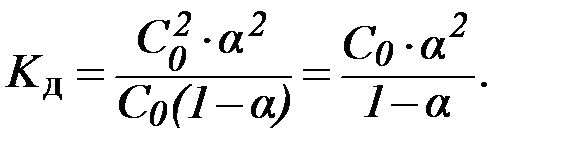
Данное соотношение выражает закон разведения Оствальда.
Для слабых электролитов a << 1, поэтому можно записать:
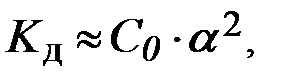 или
или 
Таким образом, закон Оствальда можно сформулировать следующим образом:
Степень диссоциации слабого электролита возрастает с разбавлением раствора.
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы.
Закон Оствальда: С увеличением разведения (уменьшением концентрации электролита) степень диссоциации электролита возрастает.
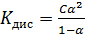
 2020-01-15
2020-01-15 115
115








