Иным подходом к классификации веществ с точки зрения отнесения их к кислотам и основаниям явилась электронная теория Льюиса. В рамках электронной теории:
Кислота - частица/молекула способную присоединять электронную пару (акцептор электр. пары)
E- электрофил;
Основание - частица/молекула способную отдавать электронную пару (донор).
N- нуклеофил.
Согласно представлениям Льюиса, кислота и основание взаимодействуют друг с другом с образованием донорно-акцепторной связи. В результате присоединения пары электронов у атома с электронным дефицитом возникает завершенная электронная конфигурация - октет электронов.
По Льюису происходит перенос пары электронов от основания к кислоте. Образуется кислотно-основный продукт.
Кислотой Льюса считается частица с зарядом +, либо свободная орбиталь.
Осованием Льюиса считается частица с зарядом -, либо с электронной парой.
Примеры:
1. 
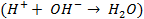
2. 
3. 
Ионное произведение воды.
21.
Ионное произведение воды – произведение концентрации ионов водорода на концентрацию гидроксид иона.
Вода относится к очень слабым амфотерным электролитам. Чистая вода в незначительной степени диссоциирует на ионы: H2O⇄Н+ + ОН-.
В водном растворе ионы водорода не существуют в свободном состоянии, а образуют ионы гидроксония Н3О+. Поэтому более строгой является следующая запись процесса диссоциации воды:
2H2O ⇄ Н3O+ + ОН-.
Однако для простоты пишут Н+.

Константу KW, равную произведению концентраций ионов Н+ и ОН-, называют ионным произведением воды. При данное температуре это величина постоянная.
В водных растворах различных соединений в зависимости от соотношения концентраций ионов Н+ и ОН– реакция среды может быть:
нейтральная:
[H+] = [OH-] = 10-7 моль/л;
кислая:
[H+] > [OH-],
[H+] > 10-7 моль/л; [OH-] < 10-7 моль/л;
щелочная:
[H+] < [OH-],
[H+] < 10-7 моль/л; [OH-] > 10-7 моль/л.
Водородный показатель. Гидроксильный показатель. Их взаимосвязь.
22.
Водородный показатель (рН) - количественная характеристика активной кислотности.
рН = –lg[H+], или рН = –lgC(Н+)
Кроме водородного показателя, используется гидроксидный показатель рОН (часто говорят: гидроксильный показатель), который связан с концентрацией ОН–-ионов в растворе соотношением:
 , так как при t0 = 20-250С pKW = 14 (KW = 10-14), то при этой температуре: pH+pOH = 14
, так как при t0 = 20-250С pKW = 14 (KW = 10-14), то при этой температуре: pH+pOH = 14
При помощи водородного показателя удобно выражать характер среды:
нейтральная среда: рН = 7 (рН = рОН),
кислая среда: рН < 7 (рН < рОН),
щелочная среда: рН > 7 (рН > рОН).
рНкрови ≈ 7,4
рНкожи ≈ 5,5
Сдвиг соотношения концентраций ионов H+ и OH- в сторону увеличения активной кислотности (ацидоз) вызывает уменьшение рН Сдвиг этого соотношения в сторону уменьшения активной кислотности (алкалоз) вызывает увеличение рН (может развиваться вследствие потери организмом анионов кислот или задержки щелочных катионов; при кишечной непроходимости, при нарушении выведения почками натрия, при поступлении в организм значительных количеств щелочных веществ с пищей или лекарственными препаратами, при отравлениях и по другим причинам).
 2020-01-15
2020-01-15 130
130








