В основу данной теории был положен очевидный факт, что в концентрированных растворах сильных электролитов, вследствие их полной диссоциации, содержится значительно большее количество ионов по сравнению с растворами слабых электролитов. Это приводит к тому, что в растворах сильных электролитов наблюдается межионное взаимодействие, в результате которого вокруг каждого иона концентрируются ионы противоположного знака, образуя так называемую «ионную атмосферу». Таким образом, экспериментально определяемая степень диссоциации оказывается меньше 100% и потому она называется кажущейся степенью диссоциации aк(кажущееся).
Активность ионов - количество ионов, не занятых в межионных взаимодействиях.
Активность иона а(X) связана с его концентрацией следующим соотношением:

, где a (X) – активность иона X, моль/л; С(X) – молярная концентрация иона X, моль/л;
f(X) – коэффициент активности иона X.
Коэффициент активности f(X) - степень отклонения раствора с концентрацией С(X) от поведения раствора при бесконечном разбавлении.
В растворах сильных электролитов коэффициенты активности определяют при помощи предельного закона Дебая-Хюккеля:

где 0,5 – множитель, учитывающий влияние температуры; f(X) – коэффициент активности иона X; Z(X) – заряд иона X; I – ионная сила раствора.
Ионная сила раствора, ее расчет для сильных электролитов.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе.
Сильные электролиты отличаются большим кол-вом ионов в растворе, ионы взаимодействуют: притягиваются, отталкиваются, поэтому возникает ионная сила раствора.
Ионная сила раствора представляет собой полусумму произведений концентраций всех ионов раствора и квадратов их зарядов:
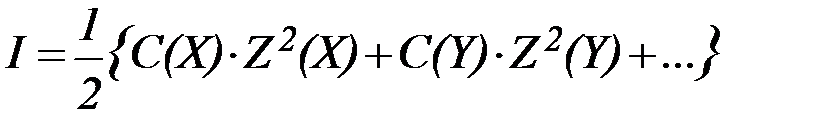
 ,
,
где С- концентрация данного иона; Z- заряд иона.
 2020-01-15
2020-01-15 465
465








