23.
· В водных растворах сильных кислот (HNO3, HCl, H2SO4 и др.):
· 
· В водных растворах сильных оснований (NaOH, КОН, Са(ОН)2, Sr(OH)2 и др.):
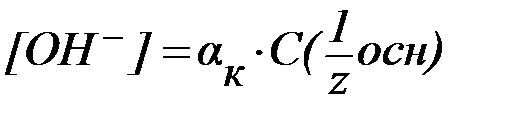 .
.
Расчет рН растворов слабых кислот и щелочей.
· В растворах слабых кислот (H2CO3, HCN, СН3СООН и др.):
 ;
;
· В растворах слабых оснований (NH3∙H2O):
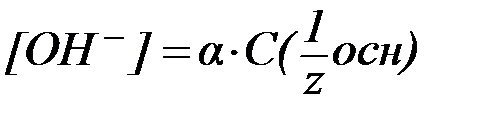 .
.
Понятие гидролиза солей, факторы, влияющие на величину степени гидролиза соли.
25.
Гидролиз - обменное взаимодействие ионов соли с водой, приводящее к образованию малодиссоциированных соединений или ионов, что вызывает изменение рН раствора.
Виды:
1) Соль образована слабой к-той и сильным основанием. (гидролиз по аниону)
Гидролиз идет по слабому, среда определяется по сильному.
2) Соль образована сильной к-той и слабым основанием. (гидролиз по катиону)
3) Соль образована слабой к-той и слабым основанием.
Гидролиз полный и необратимый.
4) Соль образует сильная к-та и сильное основание.
Гидролиз солей, приводящий к образованию кислой среды. Приведите примеры.
26.
Соли, образованные катионами слабого основания и анионами сильной кислоты (NH4C1, FeSO4, ZnCl2 и др.).
Соли этого типа за счет гидролиза в водных растворах имеют кислую реакцию. Этот случай гидролиза называется гидролизом по катиону.
Гидролиз солей, приводящий к образованию щелочной среды. Приведите примеры.
Соли, образованные катионами сильного основания и анионами слабой кислоты (CH3COONa, KCN, Ca(OCl)2, NaF и др.).
Соли этого типа за счет гидролиза в водных растворах имеют щелочную реакцию. Этот случай гидролиза называется гидролизом по аниону.
 2020-01-15
2020-01-15 116
116








