Данная тема является одной из наиболее важных в физической и коллоидной химии, т. к. поверхностные явления имеют широкое производственное применение. Так, например, на явлениях смачивания адсорбции основано обогащение руд, гетерогенный катализ, процессы крашения тканей, дубления кожи, осветления бульонов. Правильное хранение товаров с сохранением при этом их качества также связано с явлением адсорбции, так как многие товары сами поглощают водяные пары и газы, т. е. являются хорошими сорбентами.
Свойства поверхности раздела фаз резко отличаются от свойств самой фазы вследствие того, что на границе раздела любых фаз сосредоточена поверхностная энергия, избыточная по сравнению с энергией в объеме фазы. Поверхностная энергия (энергия Гиббса поверхности) определяется величиной поверхностного натяжения σ и суммарной поверхностью раздела фаз S и рассчитывается по уравнению:
Δ G = σ· S.
Поверхностное натяжение – это свободная поверхностная энергия, приходящаяся на единицу межфазной поверхности. Оно характеризует различия в интенсивности межмолекулярных взаимодействий граничащих фаз: чем больше эти различия, тем больше σ.
Положение капли жидкости на твердой поверхности при контактном смачивании (Рис.1.(а)) определяется значениями поверхностных натяжений на границе раздела следующих фаз: жидкость – газ σЖГ, твердое тело – жидкость σТЖ и твердое тело – газ σТГ. Равновесие капли определяется одновременным воздействием этих трех поверхностных натяжений и в условиях равновесия выполняется соотношение:
(уравнение Юнга):  ,
,
где θ – краевой угол смачивания или просто угол смачивания – угол между поверхностью твердого тела и касательной в точке соприкосновения трех фаз. θ всегда измеряют со стороны жидкости, он является мерой смачивания и может изменяться от 0 до 180о.
 |  |
| а | б |
| Рис.1 Положение капли жидкости на гидрофильной (а) и гидрофобной (б) поверхностях. | |
По значению краевого угла все поверхности делят на 2 группы:
– лиофильныеповерхности, если угол θ изменяется в пределах: 0 < θ < 90о (Рис.1 (а)), если поверхности контактируют с водой, то поверхности называют гидрофильными, если с неполярной жидкостью – олеофильными;
– лиофобные поверхности (гидрофобные, олеофобные), если θ > 90о (Рис.1 (б)).
Гидрофильность означает сродство к воде, гидрофобность – отсутствие такого сродства.
Равновесная работа адгезии жидкости на твердом теле равна:
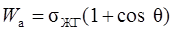 .
.
Адсорбция – увеличение концентрации вещества на поверхности раздела фаз по сравнению с его концентрацией в объеме. Вещество, которое адсорбирует другое вещество, называется адсорбентом. Вещество, которое адсорбируется – адсорбтив; это же вещество в адсорбированном состоянии (после адсорбции) называется адсорбатом. Процесс, обратный адсорбции, называется десорбцией.
В зависимости от природы адсорбционных сил различают физическую адсорбцию, когда взаимодействие адсорбента и адсорбата осуществляется за счет межмолекулярных сил, и химическую адсорбцию (хемосорбцию), протекающую в результате химической реакции адсорбата с адсорбентом с образованием нового поверхностного соединения.
Количественно адсорбцию описывают следующими параметрами:
– абсолютная адсорбция А – это количество адсорбата на единице поверхности адсорбента;
– избыточная или гиббсовская адсорбция Г (гамма) – это избыток адсорбата в поверхностном слое по сравнению с его первоначальным количеством в объеме фазы.
Когда концентрация адсорбата на поверхности адсорбента значительно превышает его концентрацию в объеме, считается, что Г = А.
Если Г (А) > 0, адсорбцию называют положительной,
если Г (А) < 0, имеет место отрицательная адсорбция.
Мономолекулярная адсорбция (адсорбция Ленгмюра) заключается в следующем: адсорбция происходит не на всей поверхности адсорбента, а лишь в отдельных ее точках (активных центрах); энергия адсорбции для всех молекул одинакова; в результате адсорбции образуется один слой (монослой) адсорбированных молекул, взаимодействием между молекулами в котором незначительно. Мономолекулярная адсорбция происходит в результате физической адсорбции газов при небольших давлениях и температурах, а также в результате хемосорбции.
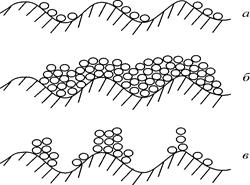 |
| Рис.2 Схема адсорбции: а – мономолекулярной; б – полимолекулярной согласно теории Поляни; в – полимолекулярной согласно теории БЭТ. |
Полимолекулярную адсорбцию характеризует изотерма, имеющая S-образную форму. Этот вид адсорбции связан с образованием на поверхности адсорбента более одного слоя молекул адсорбата. Полимолекулярная адсорбция может проявляться в двух случаях:
1. Потенциальная адсорбция (адсорбция Поляни) происходит, когда на поверхности адсорбента отсутствуют активные центры, а вблизи поверхности адсорбента существует потенциальное адсорбционное силовое поле, которое убывает по мере увеличения расстояния от поверхности. Под воздействием силового поля возникает возможность образования нескольких слоев молекул адсорбата (Рис.3(б)). Наибольшее притяжение и сжатие испытывает 1-й адсорбционный слой; газообразные продукты в нем конденсируются в жидкость. Эта теория характеризует адсорбцию на пористых адсорбентах.
2. Адсорбция БЭТ (Брунауэра, Эммета, Теллера) происходит при наличии активных центров на поверхности. Каждая молекула, адсорбированная в 1-м слое, является активным центром для молекул, образующих 2-й слой адсорбата, и т.д., при этом адсорбированные молекулы не взаимодействуют между собой. В результате на поверхности также образуется несколько слоев адсорбата (Рис.3(в)). Такой вид адсорбции происходит в случае адсорбции паров и газов на твердых поверхностях.
Для описания процесса адсорбции используют несколько аналитических уравнений, которые называют по имени их авторов.
1) Фундаментальное уравнение адсорбции Гиббса применимо для описания процесса адсорбции на любых поверхностях раздела (жидкость – газ; жидкость – твердое тело; газ – твердое тело):
 ,
,
где С – молярная концентрация адсорбтива;  – изменение поверхностного натяжения раствора при изменении концентрации на dС.
– изменение поверхностного натяжения раствора при изменении концентрации на dС.
Величину  считают мерой способности вещества снижать свободную поверхностную энергию на данной границе раздела, ее обозначают
считают мерой способности вещества снижать свободную поверхностную энергию на данной границе раздела, ее обозначают
 , величину g называют поверхностной активностью.
, величину g называют поверхностной активностью.
По значению поверхностной активности все вещества разделяют на:
– поверностно-неактивные вещества, g = 0, не влияют на значение поверхностное натяжение на границе раздела фаз;
– поверхностно-инактивные вещества, g < 0, – увеличивают σ;
– поверхностно-активные вещества (ПАВ), g > 0, – уменьшают σ.
По отношению к водным растворам поверхностно-активными веществами являются жирные кислоты, мыла, спирты, амины и др. соединения, имеющие дифильную структуру молекул, т.е. в их составе находятся одновременно неполярная и полярная части. Молекулу ПАВ условно изображают так:  .
.
Механизм действия ПАВ заключается в следующем: при адсорбции полярная группа, обладающая большим сродством к полярной фазе, втягивается в воду, в то время как неполярный углеводородный радикал выталкивается в неполярную фазу. Т.о., молекулы ПАВ самопроизвольно накапливаются на поверхности раздела фаз в избыточном по сравнению с объемом количестве, т.е. происходит положительная адсорбция. При этом происходит уменьшение свободной поверхностной энергии, что ограничивает размеры поверхностного слоя толщиной в одну молекулу – образуется мономолекулярный слой. В зависимости от концентрации ПАВ ориентация их молекул имеет вид (Рис.3):
 |  |  |
| а | б | в |
| Рис.3 Ориентация молекул ПАВ на поверхности водного раствора при малых концентрациях (а), при умеренных концентрациях (б), в насыщенном адсорбционном слое (в). | ||
Согласно правилу Дюкло-Траубе при удлинении цепи ПАВ на одну группу –СН2– их поверхностная активность возрастает в 3-3,5 раза.
2) Уравнение Ленгмюра применимо для описания адсорбции на любых границах раздела фаз:
 ,
,
где К – константа равновесия адсорбции (т.е. отношение констант скоростей адсорбции и десорбции);  – предельная адсорбция (максимальная).
– предельная адсорбция (максимальная).
3) Уравнение Фрейндлиха применимо на границах раздела газ – твердое тело и жидкость – твердое тело:
 ,
,
где х – количество адсорбата; m – масса адсорбента; k, 1/n – константы, зависящие от природы газа и температуры.
Литература: [4, гл.3, § 1-11].
1. Что такое поверхностное натяжение и как его измерить?
2. Какие вещества являются поверхностно-активными? Как построены ихмолекулы?
3. Что такое сорбция и каковы ее виды?
4. Что такое молекулярная адсорбция и какому уравнению она подчиняется?
5. Как найти размеры молекул поверхностно-активного вещества, если известна Г∞?
6. Из какого растворителя лучше адсорбируется поверхностно-активное вещество на угле: из воды или из бензола?
7. Сформулируйте правила избирательной адсорбции ионов.
8. Что является мерой смачиваемости твердой поверхности данной жидкостью?
9. Исследуйте уравнениеГиббса.
 2020-01-14
2020-01-14 2636
2636
