Тиоспирты могут быть получены действием галоидных алкилов, солей алкилсерных кислот или диалкилсульфатов на кислый сернистый калий или натрий:
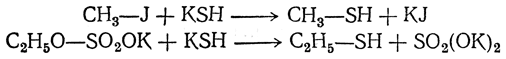
Кроме того, они могут быть получены энергичным восстановлением сульфокислот или их хлорангидридов:

В настоящее время меркаптаны очень просто получаются действием хлористых или бромистых алкилов или диалкилсульфатов на тиомочевину

с последующим расщеплением щелочью полученного продукта:
Вода представляет собой жидкость, сероводород при комнатной температуре — газ; вода не имеет запаха, сероводород сильно и неприятно пахнет. В соответствии с этим меркаптаны кипят значительно ниже спиртов, и запах меркаптанов — один из самых отвратительных и сильных запахов, какие встречаются у органических веществ. Метилмеркаптан кипит уже при 6° С. Этилмеркаптан кипит при 37° С, его относительная плотность 0,839 при 20° С. Меркаптаны, даже низшие, мало растворимы в воде, но хорошо растворимы в спирте и эфире.
1. Образование меркаптидов. Сероводород является слабой кислотой, и меркаптаны в отличие от спиртов могут растворяться в едких щелочах, давая соединения типа R—S—Na, в которых водород сульфгидрила замещен на металл. Эти соединения называются меркаптидами.
Меркаптаны легко дают соли (меркаптиды) также и с окислами тяжелых металлов. Особенно легко образуются хорошо кристаллизующиеся из спирта бесцветные ртутные меркаптиды:

От названий этих ртутных соединений (corpus mercurio aptum) и произошло название меркаптанов.
Свинцовые и медные меркаптиды имеют желтый цвет.
Поведение меркаптидов по отношению к кислотам очень напоминает поведение сернистых металлов. Соляная кислота легко вытесняет меркаптан из натриевого меркаптида и трудно — из ртутного и из меркаптидов некоторых других тяжелых металлов.
2. Действие окислителей. Слабые окислители, такие, как гидроксиламин, серная кислота и даже кислород воздуха в присутствии аммиака, окисляют меркаптаны в дисульфиды:

Сильные окислители, как, например, азотная кислота, окисляют меркаптаны в сульфокислоты:

Дисульфиды можно получить также действием иода на меркаптиды

и перегонкой солей алкилсерных кислот с двусернистым калием:

Дисульфиды представляют собой тяжелые жидкости с неприятным запахом, имеющие значительно более высокие температуры кипения, чем меркаптаны (диэтилдисульфид кипит при 112° С; относительная плотность 1,064 при 0°С). Под действием восстановителей дисульфиды превращаются в меркаптаны:
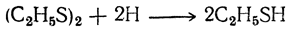
3. Образование тиоэфиров карбоновы х кислот. При действии на меркаптаны карбоновых кислот или их хлорангидридов получаются тиоэфиры карбоновых кислот:

Метилмеркаптан CH3SH образуется при гидролизе кератина шерсти и гниении белковых веществ, содержащих серу. Он находится также в человеческих испражнениях, являясь вместе со скатолом причиной их неприятного запаха.
Высшие меркаптаны обладают сравнительно слабым запахом. За последнее время стали получать в довольно значительных количествах додецил-, или лаурилмеркаптан, C12H25SH, применяемый в производстве синтетического каучука как регулятор эмульсионной полимеризации. Это — жидкость, кипящая при 153—155° С при 24 мм; относительная плотность 0,845 при 20° С.
 2020-04-12
2020-04-12 1012
1012








