Низшие гомологи нитросоединений — жидкости, не имеющие неприятного запаха, нерастворимые в воде, смешивающиеся со спиртом и эфиром. Нитрометан кипит при 101° С; у последующих гомологов температуры кипения повышаются, обнаруживая правильности, общие для всех гомологических рядов. Плотности низших нитросоединений больше единицы; с увеличением молекулярного веса плотности нитросоединений уменьшаются.
Химические свойства.
1. Действие щелочей и обра зование изонитросоединений.
Нитросоединения ряда метана — вполне нейтральные вещества. Однако первичные и вторичные нитросоединения при взбалтывании с растворами едких щелочей медленно растворяются в них, образуя растворимые в воде вещества, обладающие всеми свойствами нейтральных солей. Эти вещества представляют собой собственно не соли нитросоединений, а соли изомерных им изонитросоединений, являющихся сильными кислотами.
Взаимодействие нитросоединений с щелочами протекает следующим образом:
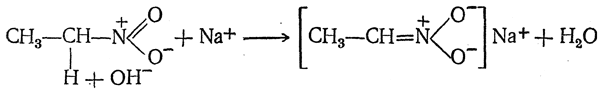
Изомеризация нейтральных нитросоединений в кислые изонитросоединения подтверждается тем, что при действии сильной кислоты на соль изонитросоединения (I) нерастворимое в воде нитросоединение (III) получается не сразу; сначала выделяется хорошо растворимое в воде изонитросоединение (II), лишь постепенно превращающееся в нитросоединение (III):
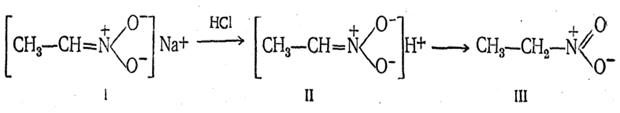
Простейшие изонитросоединения не удалось выделить в чистом виде, так как их превращение в истинные нитросоединения происходит очень быстро, хотя и не мгновенно. Некоторые более сложные изонитросоединения были получены и в чистом виде.
Случаи, подобные превращениям нитросоединений, когда нейтральные вещества со щелочами дают соли изомерных им сильных кислот, а также когда нейтральные вещества с кислотами дают соли сильных оснований, нередки среди органических веществ и относятся к области явлений таутомерии.
Нейтральным веществам, ведущим себя подобным образом, Ганч дал названия псевдокислот и соответственно псевдооснований.
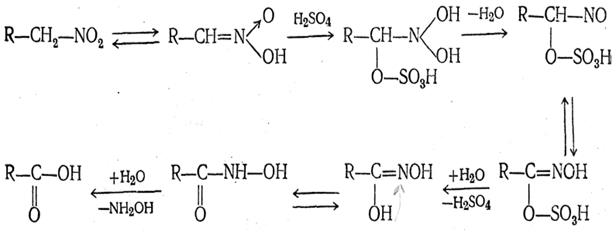
2. Действие концентрированных минеральных кислот. При действии концентрированных минеральных кислот нитросоединения превращаются в карбоновые кислоты, отщепляя гидроксиламин. Это превращение происходит по следующей схеме:
3. Действие азотистой кислоты. Весьма характерной реакцией, позволяющей различить первичные, вторичные и третичные нитросоединения, является их взаимодействие с азотистой кислотой.
а) Первичные нитросоединения (и нитрометан) реагируют с азотистой кислотой, выделяя молекулу воды и образуя так называемые нитроловые кислоты:
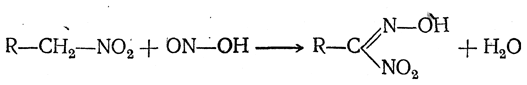
Щелочные соли нитроловых кислот окрашены в ярко-красный цвет, являющийся при этой реакции признаком первичного нитросоединения.
б) Вторичные нитросоединения с азотистой кислотой также выделяют воду, давая соединения, называемые псевдонитролами:
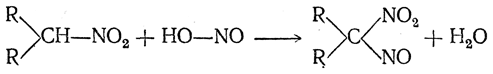
Эти вещества в кристаллическом состоянии бесцветны, но в расплавленном состоянии и в растворах (в эфире, хлороформе и пр.) обладают интенсивной бирюзовой окраской.
в) Третичные нитросоединения не реагируют с азотистой кислотой.
Эти реакции играют важную роль при установлении строения углеводородных радикалов не только у нитросоединений, но и у галоидных алкилов, спиртов и других веществ, которые легко превратить в нитросоединения.
4. Действие галоидов на щелочные растворы нитросоединений. Этим способом можно заместить во вторичных нитросоединениях один, а в первичных нитросоединениях один или два атома водорода на атомы галоида и получить таким образом соединения:
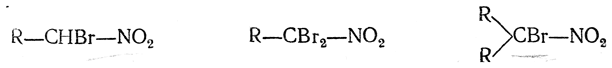
Такое строение образующихся галоиднитросоединений доказывается тем, что при действии на них цинкорганических соединений галоид замещается на алкил и получаются высшие гомологи нитросоединений (И. И. Бевад):
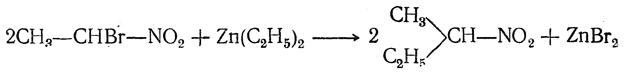
5. Восстановление. При восстановлении нитросоединений образуются первичные амины:

Эта реакция доказывает, что в нитросоединениях атом азота непосредственно связан с атомом углерода алкила. Напротив, при восстановлении изомерных нитросоединениям эфиров азотистой кислоты, в которых алкил связан с кислородом, получаются спирт и аммиак или гидроксиламин:
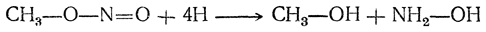
Впервые синтез первичных аминов восстановлением нитросоединений был осуществлен Н. Н. Зининым (1842) применительно к ароматическим соединениям (получение анилина и α-нафтиламина). В дальнейшем восстановление ароматических нитросоединений было широко изучено и сделалось основным способом получения ароматических аминов.
Восстановление жирных нитросоединений значительно менее изучено. Однако и здесь уже известны реакции, при которых получаются продукты неполного восстановления, например альдоксимы и кетоксимы. Вероятно, в этих случаях восстанавливаются изонитросоединения:

Оксимы в условиях восстановления оловом и соляной кислотой могут гидролизоваться, распадаясь на гидроксиламин и альдегиды или кетоны, или давать β-алкилгидроксиламины R—СН2—NH—ОН.
6. Конденсация с альдегидами. Первичные и вторичные нитросоединения под действием щелочей легко вступают в реакции конденсации с альдегидами за счет атомов водорода, находящихся в α-положении к нитрогруппе. При этом с формальдегидом реагируют все имеющиеся α-атомы водорода, а с другими альдегидами только один такой атом. Соответственно, нитрометан с формальдегидом образует трехатомный спирт
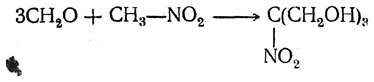
который, подобно глицерину, при этерификации азотной кислотой дает тринитрат C(NO2)(CH2ONO2)3, чрезвычайно мощное взрывчатое вещество.
С другими альдегидами получаются одноатомные спирты:
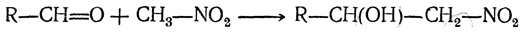
При известных условиях получившийся нитроспирт может терять элементы воды и превращаться в R—СН=СН—NO2.
Амины
Аминами называются соединения, которые могут быть произведены от аммиака замещением в нем атомов водорода на углеводородные радикалы.
В молекуле аммиака можно заместить на радикалы один, два или три атома водорода и таким образом получить амины следующих трех типов:
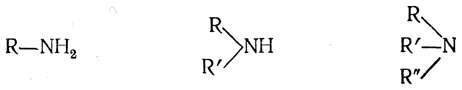
Эти типы аминов по числу атомов водорода, замещенных радикалами, называются первичными, вторичными и третичными аминами. Амины относят к соответствующему типу независимо от того, какие радикалы R (первичные, вторичные или третичные) входят в их состав. Следовательно, применительно к аминам терминам первичный, вторичный и третичный придается другое значение, чем в названиях радикалов.
Названия аминов обыкновенно производят от названий входящих в них радикалов с присоединением слова амин. Таким образом возникают названия: метиламин СН3—NH2, диметиламин (CH3)2NH, триметиламин (CH3)3N, пропиламин
СН3—СН2—СН2—NH2, втор -бутиламин
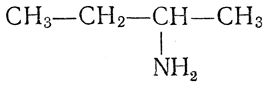
трет -бутиламин (СН3)3С—NH2 и т. д.
Изомерия аминов происходит как от изомерии радикалов (собственно изомерия), так и от того, что в молекуле амина может быть несколько различных радикалов (метамерия). Так, например, диметиламин (CH3)2NH изомерен (метамерен) этиламину СН3—СН2— NH2.
Аммиак, соединяясь с кислотами, образует соли аммония. Они не являются соединениями пятивалентного азота, как это полагали ранее. Реакцию образования солей аммония следует представлять себе таким образом: ион водорода (протон) присоединяется к атому азота, обладающему свободной парой электронов, причем образуется ковалентная связь между азотом и водородом. Атом азота приобретает положительный заряд, и вновь возникающее образование становится катионом, который связывается с анионом хлора ионной связью:
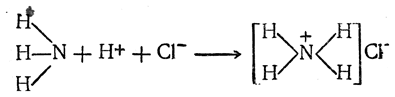
В солях аммония можно последовательно заместить от одного до четырех атомов водорода на углеводородные радикалы и получить таким образом соли органических замещенных аммониевых оснований, например:

Последняя соль называется хлористым тетраметиламмонием.
Действием натрийбензила на хлористый тетраметиламмоний удалось получить твердое вещество, в котором, казалось бы, у атома азота находятся пять углеводородных радикалов:
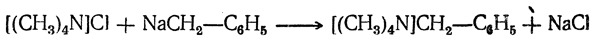
Однако все свойства этого вещества, начиная от глубокой окраски, доказывают, что этот продукт является аналогом исходного натрийбензила и что группировка [(CH3)4N) играет в нем роль металла. Растворы этого вещества проводят электрический ток, и при электролизе радикал бензил ведет себя как анион. Таким образом, азот и бензильный радикал связаны между собой не ковалентной, а ионной связью.
Способы получения
1. Действие галоидных а л к а лов на аммиак и амины. Подобно присоединению к аммиаку галоидоводородной кислоты с образованием, например, хлористого аммония, может присоединяться к аммиаку и галоидный алкил, образуя соль однозамещенного аммония (реакция Гофмана): 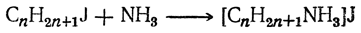
Эта соль в процессе реакции частично разлагается непрореагировавшим аммиаком с выделением первичного амина:
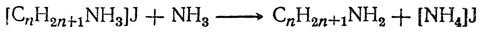
Первичный амин может, в свою очередь, присоединить галоидный алкил, образуя соль двузамещенного аммония
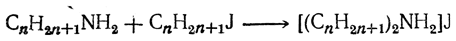
из которой при дальнейшем действии аммиака может образоваться вторичный амин (C n H2 n +1)2NH.
Совершенно аналогично вторичный амин, далее дает соль трехзамещенного аммония [(C n H2 n +1)3NH]J и затем — третичный амин (C n H2 n +1)3N. Наконец, и третичный амин, присоединяя галоидный алкил, дает соль четырехзамещенного аммониевого основания [(С n Н2 n +1)4N]J, которая уже не разлагается аммиаком. Поэтому при действии аммиака на галоидные алкилы обыкновенно получается смесь солей всех четырех аммониевых оснований: например, иодистый метил дает смесь солей метиламина, диметиламина, триметиламина и тетраметиламмония.
Эфиры минеральных кислот реагируют с аммиаком и аминами, подобно галоидным алкилам, например:
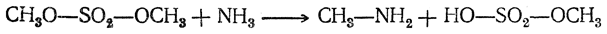
2. Взаимодействие спиртов с аммиаком. Амины (первичные, вторичные и третичные) могут быть получены пропусканием смеси паров спирта и аммиака через нагретые окислы двухвалентных и трехвалентных металлов (чаще всего алюминия или тория) или тонко раздробленные металлы группы железа, играющие роль катализаторов:
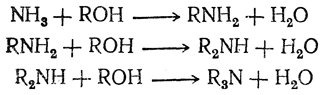
Этим методом в технике получают простейшие амины.
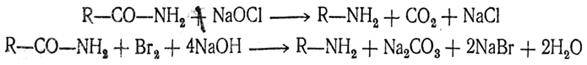
3. Получение из амидов кислот. Действием щелочных гипохлоритов (гипобромитов) или галоидов в щелочной среде на амиды кислот образуются первичные амины, содержащие на один атом углерода меньше, чем исходный амид (реакция Гофмана):
4. Получение из азидов кислот. При нагревании азидов кислот выделяется молекула азота и остаток молекулы азида, промежуточно образуя изоцианат (перегруппировка Курциуса), дает окончательно первичный амин:
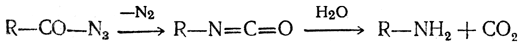
5. Взаимодействие карбоновых кислот с азотистоводородной кислотой. Первичные амины получаются при действии азотистоводородной кислоты на карбоновую кислоту в присутствии концентрированной серной кислоты (реакция Шмидта):
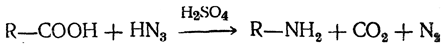
6. Омыление эфиров изоциановой кислоты и изонитрилов. Первым способом, при помощи которого были открыты амины (Вюрц, 1848), является действие щелочей на эфиры изоциановой кислоты. При этом получаются первичные амины
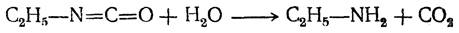
и как побочные продукты — вторичные и третичные амины.
Омыление изонитрилов (при действии кислот) также приводит к образованию первичных аминов:
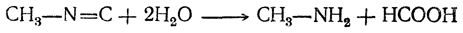
7. Восстановление азотистых соединений. Амины могут быть получены восстановлением азотистых соединений, прежде всего нитросоединений:
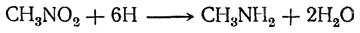
Все другие азотистые органические соединения, например цианистые соединения (нитрилы), оксимы, изонитрилы, при восстановлении также дают амины:
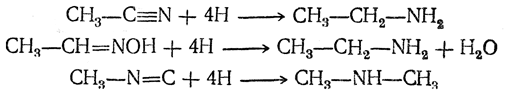
8. Получение аминов восстановительным алкилированием. Альдегиды и кетоны под действием аммиака с одновременным восстановлением водородом превращаются в амины:
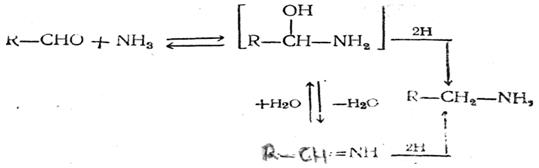
Восстановление может производиться как водородом in statu nascendi, так и газообразным водородом в присутствии катализатора (скелетный никелевый катализатор Ренея, меднохромовый катализатор и др.). Если вместо аммиака взять первичный или вторичный амин, то получится соответственно вторичный или третичный амин. Этим путем хорошо получать амины из кетонов и высших альдегидов. С низшими альдегидами реакция протекает сложнее, так как образующиеся амины и промежуточные шиффовы основания R—CH=N—R' легко вступают во вторичные реакции.
9. Реакция Лейкарта. Особым случаем восстановительного алкилирования аминов является реакция Лейкарта, при которой восстановителем служит муравьиная кислота или ее производные, например:
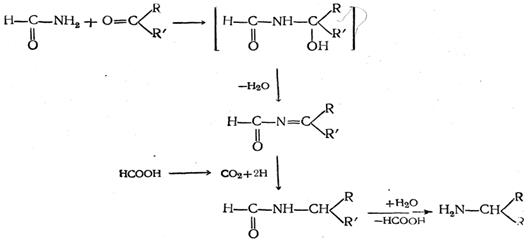
Если вместо кетона взять формальдегид, то образующийся первичный амин может вновь вступать в реакцию (вместо формамида) и давать вторичные и третичные амины.
10. Бактериальные процессы. Амины образуются в небольших количествах при различных бактериальных процессах, например при гниении органических остатков, содержащих белковые вещества. Простейшие амины найдены также среди продуктов нормальной жизнедеятельности некоторых растений.
 2020-04-12
2020-04-12 206
206








