*Получение:
В промышленности
1)Путём разгонки (ректификации) жидкого воздуха.
В лаборатории
2) NH4NO2  N2↑ + 2H2O разложение нитрита аммония
3) NaNO2 + NH4Cl N2↑ + 2H2O разложение нитрита аммония
3) NaNO2 + NH4Cl  N2↑ + NaCl + 2H2O взаимодействие нитрита натрия с хлоридом аммония
4) (NH4)2Сr2 O7 N2↑ + NaCl + 2H2O взаимодействие нитрита натрия с хлоридом аммония
4) (NH4)2Сr2 O7  N2↑ + Cr2O3 + 4Н2О разложение
дихромата аммония N2↑ + Cr2O3 + 4Н2О разложение
дихромата аммония
|
| Физические свойства: Газ без цвета и запаха, очень плохо растворим в воде, не ядовит. В 1,036 раза легче воздуха. |
Химические свойства:
Очень инертное вещество. Это объясняется электронным строением молекулы азота. В молекуле азота присутствует тройная ковалентная неполярная связь::N≡N: При обычных условиях взаимодействует только с литием.
Азот - восстановитель
1) С кислородом: N2 + O2 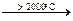 2NO↑
Азот - окислитель
2) С водородом: 3H2 + N2 2NO↑
Азот - окислитель
2) С водородом: 3H2 + N2  2NH3↑ (аммиак)
3) С металлами: 6Li + N2 → 2Li3N (нитрид лития)
3Cа + N2 2NH3↑ (аммиак)
3) С металлами: 6Li + N2 → 2Li3N (нитрид лития)
3Cа + N2  Са3N2 (нитрид кальция) Са3N2 (нитрид кальция)
|
| Применение: 1) Для получения аммиака. 2) Для создания инертных атмосфер (заполнение электроламп). 3) Жидкий азот используется для глубокого охлаждения, а также в холодильных установках. |
Основные сведения об азоте
|
|

Сейчас читают про:
 2020-05-13
2020-05-13 218
218







