Предположим, что в процессе теплообмена агрегатное состояние вещества тела не изменяется (не происходит плавление, кристаллизация, парообразование или конденсация). Начальную температуру тела обозначим t 1, конечную температуру — t 2.
Опыт показывает, что количество теплоты, полученное телом, прямо пропорционально массе тела m и разности конечной и начальной температур:
Q = cm (t 2 − t 1).
Коэффициент пропорциональности c называется удельной теплоёмкостью вещества тела. Удельная теплоёмкость не зависит от формы и размеров тела. Удельные теплоёмкости различных веществ можно найти в таблицах.
Введя обозначение ∆ t = t 2 − t 1, получим также:
Q = cm ∆ t.
Чтобы понять физический смысл удельной теплоёмкости, выразим её из последней формулы:
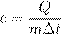 .
.
Мы видим, что удельная теплоёмкость численно равна количеству теплоты, которое необходимо для нагревания 1 кг данного вещества на 1 ◦C (или, что то же самое, на 1K). Измеряется удельная теплоёмкость в Дж / (кг · ◦C) или в Дж / (кг · K).
Чем больше удельная теплоёмкость вещества, тем большее количество теплоты требуется для нагревания тела данной массы на заданное количество градусов.
В задачах часто фигурируют вода и лёд. Их удельные теплоёмкости желательно помнить.
Дж
Вода: c = 4200.
 кг · ◦C
кг · ◦C
Дж
Лёд: c = 2100.
кг · ◦C
Произведение удельной теплоёмкости вещества на массу тела называется теплоёмкостью тела и обозначается C:
C = cm.
Соответственно, для количества теплоты имеем:
Q = C (t 2 − t 1).
 2020-05-11
2020-05-11 165
165








