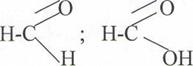1. Дайте название по систематической номенклатуре следующим соединениям:
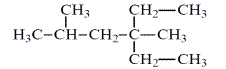
2. Напишите формулы всех возможных изомерных циклоалканов с формулой С6Н12 и дайте им названия.
3. Напишите формулы всех изомерных бутилу радикалов и дайте им названия.
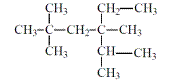
4. Приведите формулу 2,6- диметил- 3- изопропил- 3-этилгептана.
5. Укажите в вышеприведенной формуле все первичные, вторичные, третичные и четвертичные атомы углерода.
Домашнее задание.
1. Выучить все вопросы теоретической части.
2. Разобрать обучающие упражнения.
3. Выполнить задания для самостоятельной работы.
4. Подготовиться к выполнению САРС или тестового задания по изученной теме.
Занятие 3. Тема:Химические свойства алканов
Цель занятия: Изучить основные закономерности протекания реакций в насыщенных УВ
I. Вопросы к занятию.
1. Классификация реакций.
2.Типы реагентов и реакций.
3.Гомолитические и гетеролитические реакции
4.Понятие о механизмах органических реакций.
5. Реакции радикального замещения в предельных углеводородах (SR).
II. Краткая теоретическая часть.
2.1. Классификация реакций.
Способность вещества вступать в химическую реакцию и реагировать сбольшей или меньшей скоростью называется его реакционной способностью. Реакционная способность всегда должна рассматриваться только поотношению к реакционному партнеру. Само вещество при этом называют субстратом, а действующее на него соединение (реакционную частицу) – реагентом.
Органические реакции классифицируются несколькими способами.
I. По направлению(конечному результату) органические реакцииделят на несколько основных типов:
1. Реакции замещения (символ S от «substitution» – замещение).
2. Реакции присоединения (символ А от «addition» – прибавление).
3. Реакции элиминирования или отщепления (символ Е от «elimination» – отщепление) – обратные реакциям присоединения.
4. Перегруппировки. В ходе перегруппировок происходит переход
(миграция) отдельных атомов или групп от одного участка молекулы кдругому.
5. Реакции окисления (отдача электронов, изменение степени окис-
ления реакционного атома углерода).
6. Реакции восстановления (прием электронов, изменение степени
окисления).
II. По способу разрыва связи реакции делят на гомолитические (радикальные) и гетеролитические (ионные).
1. Радикальные реакции (символ R) происходятв результате гомолитического разрыва ковалентнойсвязи (гомолиз), при котором каждый из обоих ранее связанных атомовоставляет у себя по одному неспаренному электрону. Радикальные реагенты (радикалы) – свободные атомы или частицыс неспаренным электроном. (парамагнитные частицы). Гомолизу подвергаются неполярные или малополярные ковалентные связи типа С-С или С-Н, образованные общей парой электронов, реакции носят цепной характер.
2. Ионные или гетеролитические реакции (электрофильные, нуклеофильные).В ионных реакциях происходит гетеролитический разрыв ковалентной связи (гетеролиз). Гетеролизу подвергаются ковалентные связисильно поляризованные.При этом связующая электронная пара отходит к более электроотрицательному атому, в результате образуются катионы и анионы. Более подробно ионные реакции будут рассмотрены позже.
Схема разрыва химических связей при гомолитическом и гетеролитическом способах:

Большинство органических реакций включает несколько последова-
тельных (элементарных) стадий. Детальное описание совокупности этихстадий называется механизмом.
Для насыщенных углеводородов наиболее характерными являются реакции радикального замещения.
2.2.Реакции радикального замещения в предельных углеводородах (SR).
|
|
Механизм реакций SR на примере хлорирования метана:
1 стадия – инициирование. На стадии инициирования образуются свободные радикалы за счет гомолитического разрыва ковалентной связи в реагенте с образованием свободных радикалов (незаряженных частиц с неспаренным электроном), дающие начало цепному процессу.Свободные радикалы могут возникать за счет термического или фотохимического инициирования, а также в результате ОВ реакций.
hν
С1: С1 → С1∙ + С1∙
2 стадия – рост (развитие цепи) цепи. На этой стадии атака свободного радикала направлена на электронную пару С—Н, в которой углерод имеет наибольшую электроотрицательность.
СН4 + Cl∙→ CH3∙ + НCl
CH3∙ + С12 → CH3С1 + С1∙
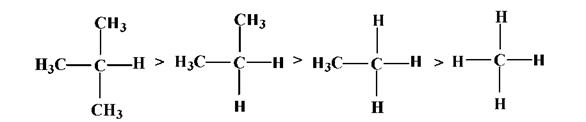
Легкость отрыва атома Н от углерод-атома у гомологов метана падает в ряду УВ (легче всего идет замещение атома у третичного, затем - вторичного и, в последнюю очередь, у первичного атома С):
|
|
3 стадия – обрыв цепи. Обрыв цепи происходит, когда встречаются два свободных радикала:
СН3∙ + С1∙ → СН3С1
По этому механизму идут реакции галогенирования алканов и циклоалканов, нитрования, сульфирования.
1. Реакции галогенирования (+С12,Вг2)
В реакциях радикального замещения алканов могут заместиться все атомы водорода на галоген. В этих реакциях получается смесь галогенопроизводных с различной степенью замещения.
Например, при действии хлора на метан происходит постепенное замещение всех атомов водорода и образуется смесь хлорпроизводных:
СН4 + Сl2® СН3Cl + HCl
свет хлористый метил
СН3Cl + Cl2®CH2Cl2 + HCl
свет дихлорметан
CH2Cl2 + CL2®CHCl3 + HCl
свет трихлорметан
(хлороформ)
СНCl3 + Cl2®CCl4 + HCl
свет тетрахлорметан
(четыреххлористый углерод)
Хлорпроизводные алканов наиболее физиологически активны. Они проявляют наркотическое действие, понижая кровяное давление. В ряду хлорзамещенных метана: СН3С1 - хлористый метил, CH2CI2- хлористый метилен, CHCI3- хлороформ, CCI4- четыреххлористый углерод - усиливаются наркотическая активность итоксичность.
Интересны реакции бромирования, так как радикалы брома (Вг∙) обладают высокой избирательностью: если в молекуле имеются вторичный, а тем более третичный атом углерода, то бромирование преимущественно идет у третичного (вторичного) атома углерода. Такие реакции называются региоселективными (избирательными по месту действия) реакциями.
|
|

|
|
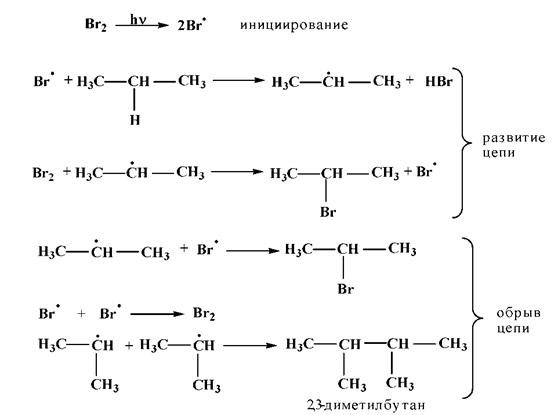
2. Нитрование. Взаимодействие алканов с разбавленной HNO3 (р-ция Коновалова)
140°
СН3 - СН3 + НО - NO2 → СНз - СН2 - NO2 + Н2О
(разб) нитроэтан
3. Сульфирование
Конц. H2SO4 при слабом нагревании сульфирует алканы:
t°
R-H + HO-HSO3→ R-HSO3 + H2O
4. Крекинг алканов:
t° 
а) С8Н18→ С4Н10 + С4Н8
бутан бутен
t°(15000C) ацетилен
б) 2СН4→ С2Н2 + ЗН2
5. Дегидрирование алканов с образованием алкенов:
400-600 оС
СН3—СН2—СН3¾¾¾® СН3—СН=СН2 + Н2
кат. (Cr2O3)
6. Окисление.
Мягкие окислители (бромная вода, КМпО4 на алканы
не действуют). Все алканы сгорают с выделением большого кол-ва
теплоты.
C5H12+ 8О2 → 5СО2 + 6 Н2О
Кроме того окислением О2(воздуха) в присутствии катализаторов:
|
|
СН4 + [О] → СН3ОН; СН4 + [О] →
Ni
СН4 + Н2О → СО + 2Н2 (750° -800°)
синтез газ
7. Изомеризация алканов.
Нормальные алканы могут превращаться в алканы с разветвленной цепью:
А1С13
СН3 - СН2 - СН2 - СНз → СН3 - СН - СН3
100° СНз
бутан изобутан
Химические свойства циклоалканов подобны алканам с открытой цепью, но в зависимости от устойчивости циклов, идут в различных направлениях.
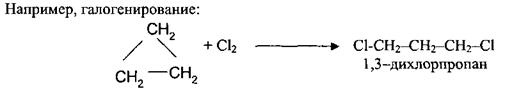
Циклоалканы с малым циклом (циклопропан) вступают в реакции присоединения, в отличие от алканов.
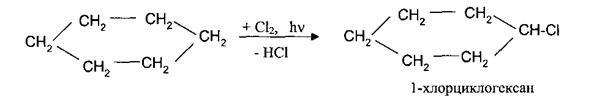
Циклогексан, также как и алканы вступает в реакцию радикального замещения:
 2020-05-25
2020-05-25 210
210