Задание 1. Нуклеофил - это частица, которая:
1. присоединяет протон
2. атакует положительно заряженный атом углерода
3. поставляет пару электронов для образования химической связи
4. поставляет свободнуюорбиталь для образования химической связи
Задание 2. Электрофил - это частица:
1. способная к образованию связи с нуклеофилом
2. способная к образованию связи со свободным радикалом
3. акцептор электронной пары
4. донор электронной пары
Задание 3. Укажите нуклеофильные частицы:
1. N02+
2. H-
3. H+
4. R-0-
Задание 4. Укажите электрофильные реагенты:
1. HS-
2. Cl+
3. R-C+=0
4. CH3-CH2+
Задание 5. Свободные радикалы:
1. электроноизбыточные системы
2. электронодефицитные системы
3. стабилизируются электронодонорами
4. образуются в полярных растворителях
Задание 6. Справедливы утверждения о том, что изопропильный радикал:
1. является третичным радикалом
2. содержит sр2-гибридный атом углерода
3. стабильнее н-пропильного радикала
4. способен отщеплять атом хлора у молекулы хлора
Задание 7. Какие утверждения верны? В реакциях электрофильного присоединения алкенов образование π-комплекса сопровождается:
1. разрушением π -связи
2. взаимодействием электронодефицитной частицы с π –связь
3. переходом атома углерода из sp2в sp3гибридное состояние
4. образованием карбокатиона
Задание 8. По механизму электрофильного присоединения протекают реакции
|
|
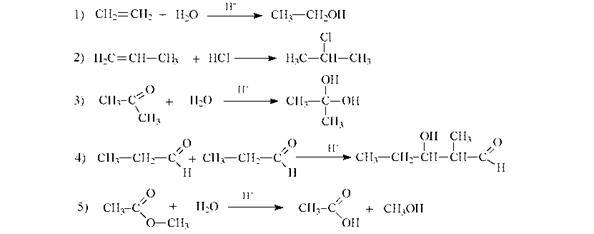
Задание 9. Приведите формулы соединений, соответствующих следующим названиям:
а) 2,5,5-триметилгептен-3 б) 2,4- дибром-5-метилгептен-1
в) 2,3-диметил-4-изопропил-4-этилгексен -1;
Задание 10. Приведите формулы всех изомерных УВ с формулой С5Н10.
Домашнее задание.
1. Выучить все вопросы теоретической части.
2. Разобрать обучающие упражнения.
3. Выполнить задания для самостоятельной работы.
4. Подготовиться к выполнению САРС или тестового задания по изученной теме.
Занятие 5. Тема: Сопряжение. Сопряженные системы с открытой цепью сопряжения. Алкадиены.
Цель занятия: Изучить сопряжение в соединениях с открытой и закрытой цепью сопряжения, критерии ароматичности.
I. Вопросы к занятию.
1. Сопряжение. Сопряженные системы с открытой цепью сопряжения. Сопряжение в молекулах бутадиена -1,3, акролеина.
2. Алкадиены. Особенности реакций присоединения к сопряженным диенам.
II. Краткая теоретическая часть.
2.1. Сопряжение. Сопряженные системы с открытой цепью.
Сопряженная система представляет собой систему, в которой имеетместо чередование простых и кратных связей или по-другому—система, в которой между кратными связями находится одна одинарная связь. В сопряженных системах имеет место дополнительное перекрывание π-электронных облаков кратной связи. Двойная связь представляет собой сочетание σ-связи и π-связи. В алкенах электронная плотность π-связи охватывает только 2 атома и ее называют локализованной. Локализованные двойные связи часто встречаются в природных соединениях, например в ненасыщенных карбоновых кислотах.
В сопряженных системах происходит такое электронное взаимодействие, при котором электронная плотность в молекуле распределяется равномерно, т.е. образуется общая электронная плотность.
Сопряжение — перераспределение (выравнивание) электронной плотности в сопряженной системе, приводящее к стабилизации моекулы.
Сопряжение возможно только в том случае, если все атомы, принимающие участие в этом процессе расположены в одной плоскости, т.е. должно выполняться условие копланарности.
Различают сопряженные системы с открытой цепью и замкнутые сопряженные системы. Возможны два типа сопряжения π,π-сопряжение (в сопряжении участвуют π-электроны кратной связи) и р,π-сопряжение (в сопряжении участвуют π-электроны кратной связи и р-электроны не поделенной электронной пары гетероатомов–N:, – O :, – S:).
Сопряжение—это энергетически выгодный процесс, происходящий с выделением энергии, поэтому для сопряженных систем характерна повышенная термодинамическая устойчивость. Количественно термодинамическую устойчивость можно оценить как разность энергий соединений с сопряженными двойными связями и соединений с изолированными двойными связями.
Эту разность называют энергией сопряжения или энергией делокализации.Термодинамическая устойчивость соединения увеличивается с увеличением длины сопряженной цепи.
Простейшей π,π-сопряженной системой этого типа является бутадиен-1,3.
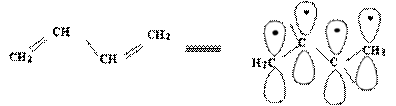
Все атомы углерода находятся в sp2-гибридизации, все σ-связи лежат в одной плоскости, четыре негибридизованные Рz -орбитали расположены перпендикулярно плоскости σ-связей и параллельны друг другу (необходимое условие для перекрывания).
Примеры соединений с Примеры соединенийс π,π-сопряжением р,π-сопряжением
Н2С= СН–СН= СН2 Н2С=СН–Cl
Бутадиен-1,3 Хлорэтен
Н2С= СН– С≡ СН2 Н2С=СН–О–С2Н5
Бутен-1-ин-3 Винилэтиловыйэфир
 2020-05-25
2020-05-25 318
318








