1. Приведите уравнение хлорирования 2-метилпропана и укажите механизм реакции.
2. Приведите уравнение нитрования этана и укажите условия и механизм реакции.
3. Приведите уравнение бромирования 2-метилбутана и укажите условия и механизм реакции.
4. Приведите уравнение нитрования 2-метилбутана и укажите условия и механизм реакции.
5. Приведите уравнение бромирования циклопропана. В чем заключается особенность реакционной способности малых циклов?
6. Приведите формулу 1-метил-2-этилциклопентана
|
|
Домашнее задание.
1. Выучить все вопросы теоретической части.
2. Разобрать обучающие упражнения.
3. Выполнить задания для самостоятельной работы.
4. Подготовиться к выполнению САРС или тестового задания по изученной теме.
Занятие 4. Тема:Ненасыщенные УВ
Цель занятия: Изучить строение, изомерию, номенклатуру и основные закономерности протекания реакций в ненасыщенных УВ
I. Вопросы к занятию.
1. Алкены. Гомологический ряд, изомерия и номенклатура.
2. Алкины. Гомологический ряд, номенклатура и изомерия алкинов.
3. Реакции электрофильного присоединения AE, механизм.
4. Физические и химические свойства, реакционная способность непредельных УВ.
II. Краткая теоретическая часть.
2.1. Алкены.
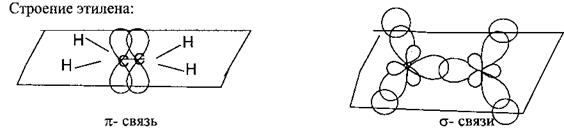
Алкенами (олефинами) называются УВ, в молекулах которых между атомами углерода имеется одна двойная связь, которая состоит из одной σ-связи и одной π-связи. Это непредельные углеводороды.
Общая формула СпН2п.
Родоначальник гомологического ряда алкенов - этилен: Н2С = СН2.
Реакционная способность алкенов определяется наличием двойной связи. Атомы углерода при двойной связи находятся в sp2 — гибридизации.
Три sp2 - гибридизованные орбитали лежат в одной плоскости под углом 120° и образуют три прочные ϭ- связи. Негибридизованная р-орбиталь, перпендикулярная плоскости ϭ- связей, участвует в образовании менее прочной и легкополяризуемой π-связи.
Изомерия.
В алкенах осуществляется
а) структурная изомерия, обусловленная:
1. Изомерией углеродного скелета
2. Положением двойной связи
3. Межклассовой изомерией (алкены изомерны циклоалканам).
б) пространственная - геометрическая цис - транс – изомерия, обусловленная различным положением заместителей относительно плоскости двойной связи. Алкены, у которых хотя бы один из атомов углерода при двойной связи имеет 2 одинаковых заместителя, не имеет цис – транс- изомеров.

Номенклатура.
Для составления названия алкенов по систематической номенклатуре выбирают по возможности самую длинную цепь, содержащую кратную связь. Нумерацию начинают с того конца, ближе к которому находится двойная связь. В названии соответствующего алкена окончание -ан заменяется на — ен.
Физические свойства
Первые три представителя - этилен, пропилен, бутилен - газы; С5 –С17 - жидкости; C18 и выше - твердые.
С увеличением молекулярной массы повышаются температуры плавления и кипения. Алкены с углеродной цепью нормального строения кипят при более высокой температуре, чем их изомеры, имеющие разветвленное строение. Температура кипения цис-изомеров выше, чем транс - изомеров. Алкены плохо растворимы в воде, но лучше, чем соответствующие алканы. Они хорошо растворяются в органических растворителях. Этилен и пропилен горят коптящим пламенем.
2.2. Алкины.
Алкинами называются непредельные УВ содержащие одну тройную связь, состоящая из одной σ-связи и двух π-связей.
Общая формула алкинов СпН2п.2.
Члены гомологического рода СН ≡ СН –этин (ацетилен), СН3 - С ≡СН – пропин (метилацетилен); СН3 - С ≡С – СН3бутин-2 (диметилацетилен)..
Атомы углерода при тройной связи находятся в SP-
гибридизации. Тройная связь состоит из 1 σ-связи между гибридными
орбиталями атомов С, и двухπ-связей, образованных перекрыванием двух
пар р - орбиталей соседних атомов углерода. Длина связи С≡С - 0,120 Нм.
Изомерия
Структурная изомерия обусловлена:
а) изомерией углеродного скелета
б) изомерией положения тройной связи
в) межклассовая изомерия (изомерны алкадиенам)
Пространственная изомерия для алкинов нехарактерна.
Номенклатура
В алкинах выбирают самую длинную цепь содержащую тройную связь и нумерацию начинают с того конца, ближе к которому находится тройная связь. В названии соответствующего алканаокончание -ан заменяется на -ин.
2.3. Реакции электрофильного присоединения(АЕ)
Гетеролитические (ионные) реакции в зависимости от электронной природы атакующей частицы делят на нуклеофильные (символ N) и электрофильные (символ Е). При этом условно принято считать одну из взаимодействующих частиц реагентом, а другую субстратом, на которую действует реагент.
Субстрат — молекула, которая поставляет атом углерода для образования новой связи.
Тип реакции (нуклеофильный или электрофильный) определяется характером реагента. Реагент с неподеленной электронной парой, взаимодействующий с субстратом, имеющим недостаток электронов, называют «нуклеофильным» (любящим, ищущим ядро), а реакции нуклеофильными.
Реагент с электронным дефицитом, взаимодействующий с субстратом, обладающим избытком электронов, называют «электрофильным», а реакцию электрофильной.
Классификация реагентов
К нуклеофильным реагентам относят молекулы, содержащие одну или более неподеленных пар электронов; ионы, несущие отрицательный заряд (анионы); молекулы, имеющие центры с повышенной плотностью.
Нуклеофильные реагенты:
а) нейтральные молекулы, имеющие неподеленные пары электронов:
NH3;R- NH2; R2NH; R3N; H2O; R - OH; R - O - R;
б) анионы: OH-; CN- ; NH2- ; RCOO- ; RS- ; Cl- ; Br-; I- ; HSO3-;
в) соединения, содержащие центры с повышенной электронной плотностью.
Электрофильные реагенты:
а) нейтральные молекулы, имеющие вакантную орбиталь: SO3, кислоты Льюиса (AlCl3, SnCl4, FeBr3, BF3);
б) катионы: протон (Н+), ионы металлов (Men+); SO3H+, NO2+, NO+;
в) молекулы, имеющие центры с пониженной электронной плотно-
стью: галогенпроизводные углеводородов - R—Hal-, (галогены Cl, Br, I).
Электрофильное присоединение характерно для ненасыщенных систем, содержащих двойные или тройные связи. Нуклеофильный характер таких соединений обусловлен наличием π-связи, которая представляет собой область с повышенной электронной плотностью, обладает поляризуемостью и легко разрывается под действием электрофильных реагентов.
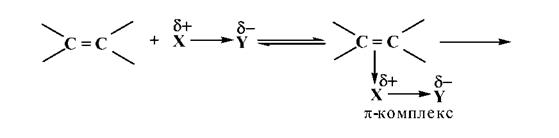
Многие реакции алкенов протекают по механизму электрофилъного присоединения - АЕ. Это, как правило, ионные реакции, протекающие в несколько стадий.
1 стадия - атака двойной связи электрофильной частицей с образованием π-комплекса;
2 стадия- разрывπ-связи и переход π-комплекса в σ-комплекс (карбокатион);
3 стадия - взаимодействие карбокатиона с анионом с Y-.
|
|
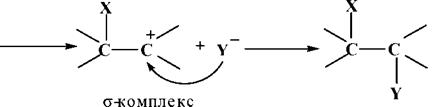
|
|
По механизму электрофильного присоединения идут практически все реакции присоединения к ненасыщенным УВ. При присоединении к несимметричным алкенам и алкинам молекул типа Н+X-, где Х – OH-, Hal-,
ион Н+ присоединяется к тому из атомов углерода при двойной
связи, на котором больше отрицательный заряд. Распределение
зарядов определяется смещением π - электронной плотности под
влиянием заместителей:
 δ+ δ-
δ+ δ-
R→ СН = СН2
Правило Марковникова:
При ионном присоединении Н+X- к несимметричным алкенам (при обычных условиях) водород присоединяется по месту двойной связи к наиболее гидрогенизированному атому углерода, а X - к менее гидрогенизированному.
Отклонения от правила Марковникова – если R- атом, или группа атомов, обладающая отрицательным индуктивным эффектом. Итак, самыми характерными рекциями алкенов являются реакции присоединения:
 2020-05-25
2020-05-25 152
152








