Идеальный газ – физическая модель реального газа, представляющая собой совокупность большого числа материальных точек, между которыми отсутствует взаимодействие. В этой модели пренебрегают двумя свойствами реального газа:
1) наличие собственных размеров атомов и молекул; они считаются материальными точками;
2) наличие взаимодействия между частицами (притяжением на больших расстояниях и отталкиванием на малых)
Как следствие этих пренебрежений реальные газы подчиняются законам идеального газа только при:
1) малых плотностях или концентрациях, когда можно пренебречь размерами молекул и их взаимодействием;
2) при температурах значительно выше температуры сжижения газа, когда кинетическая энергия значительно больше потенциальной энергии притяжения.
Термодинамические параметры газа
1 Термодинамическая температура – физическая величина, показывающая степень нагретости тел и являющаяся мерой средней кинетической энергии молекул.
В СИ термодинамическая температура измеряется в Кельвинах:
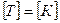 .
.
2 Объём. ВСИ объем измеряется в метрах кубических:
 .
.
3 Давление – физическая величина, характеризующая силу, действующую на единицу площади поверхности:
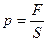 .
.
В СИ давление измеряется в Паскалях:
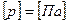 .
.
Часто на практике используются внесистемные единицы измерения давления, которые связаны с нормальным атмосферным давлением следующим образом:
101325 Па = 760 мм. рт. ст. = 1 атм. = 1 бар.
4 Плотность – физическая величина, численно равная массе вещества в единицу объема:
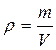 .
.
В Системе Интернациональной плотность измеряется в:
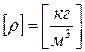 .
.
5 Удельный объем – это физическая величина, характеризующая объем единицы массы вещества, т.е. величина, обратная плотности:
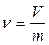 .
.
В СИ удельный объем измеряется в:
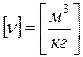 .
.
6 Концентрация характеризует количество частиц в единице объема вещества:
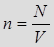 .
.
В СИ концентрация измеряется в:
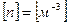
7 Количество вещества – физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы).
Молярная масса – это масса, которая приходится на один моль данного вещества.
Количество вещества определяется отношением массы m вещества к его молярной массе μ или отношением количества частиц N в данной массе вещества к числу Авогадро NА:
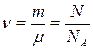 .
.
Из полученного равенства определяют количество частиц в любой массе вещества:
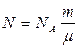 .
.
Эта формула является универсальной. Ее используют для расчета количества частиц в веществе определенной массы в ядерной физике.
Отношение числа Авогадро к молярной массе определяет массу одной молекулы:
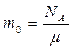 .
.
Число Авогадро 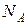 показывает количество частиц в одном моле вещества:
показывает количество частиц в одном моле вещества:
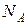 = 6,02·1023 моль-1.
= 6,02·1023 моль-1.
В СИ количество вещества измеряется в молях:
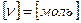 .
.
8 Взаимосвязь между концентрацией и плотностью вещества. Массу вещества можно определить по формулам:
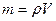 – из определения плотности вещества,
– из определения плотности вещества,
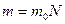 – из определения количества частиц в любой массе вещества.
– из определения количества частиц в любой массе вещества.
Приравняв правые части этих формул, получим:
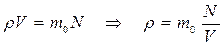 . Следовательно:
. Следовательно:  .
.
 2020-06-12
2020-06-12 1235
1235








