Уравнение состояния идеального газа связывает между собой основные термодинамические параметры газа.
Экспериментально для идеального газа получены два уравнения состояния: калорическое и термическое.
Калорическое уравнение связывает внутреннюю энергию газа с температурой:
 ,
,
где с – экспериментальная константа.
Термическое уравнение – уравнение Менделеева-Клапейрона.
Уравнение, устанавливающее связь между давлением, объемом и абсолютной температурой газов, было получено французским физиком Б. Клапейроном (1799-1864). В форме:

его впервые применил великий русский ученый Д.И. Менделеев, поэтому уравнение состояния газа называется уравнением Менделеева-Клапейрона.
Уравнение Менделеева можно записать через другие термодинамические параметры:
1 Так как  , то
, то 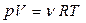 .
.
2 Если учесть, что 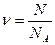 , то
, то  .
.
3 По определению плотности  , следовательно
, следовательно  .
.
4 По определению концентрации 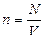 , тогда
, тогда  ,
, 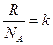 , тогда:
, тогда:
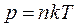 – основное уравнение МКТ,
– основное уравнение МКТ,
где 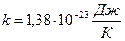 – постоянная Больцмана, которая связывает энергию и температуру.
– постоянная Больцмана, которая связывает энергию и температуру.
Уравнение Менделеева-Клапейрона справедливо только для идеальных газов.
Уравнение Менделеева-Клапейрона  для неизменной массы газа запишется в виде:
для неизменной массы газа запишется в виде:
 .
.
Точное значение постоянной в правой части этого уравнения зависит от количества газа. Если количество газа равно одному молю, то соответствующая постоянная обозначается буквой R и называется универсальной газовой постоянной:
 .
.
Это уравнение называют уравнением состояния идеального газа. Оно было получено в 1834 г. французским физиком и инженером Б. Клапейроном.
Универсальную газовую постоянную еще называют газовой постоянной:
 .
.
Для любой, но постоянной, массы газы из уравнения Менделеева-Клапейрона получаем обобщенный газовый закон: отношение произведения давления газа на объем к его температуре есть величина постоянная для неизменной массы газа:
 .
.
Если температура газа равна Tн = 273,15 К ( 0 оС), а давление pн = 1 атм = 1,013·105 Па, то говорят, что газ находится при нормальных условиях.
Как следует из уравнения состояния идеального газа, один моль любого газа при нормальных условиях занимает один и тот же объем V0, который согласно закону Авогадро равен:
V0 = 0,0224 м3 / моль = 22,4 дм3 / моль.
Для смеси невзаимодействующих газов уравнение состояния принимает вид:
 ,
,
где ν1, ν2, ν3 и т.д. – количество вещества каждого из газов в смеси.
5 Изопроцессы. Газовые законы
Следует отметить, что задолго до того, как уравнение состояния идеального газа было теоретически получено на основе молекулярно-кинетической модели, закономерности поведения газов в различных условиях были хорошо изучены экспериментально. Поэтому уравнение Менделеева-Клапейрона можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории.
Газ может участвовать в различных тепловых процессах, при которых могут изменяться все параметры, описывающие его состояние (давление, объем и термодинамическая температура). Если процесс протекает достаточно медленно, то в любой момент система близка к своему равновесному состоянию. Такие процессы называются квазистатическими. В привычном для нас масштабе времени эти процессы могут протекать и не очень медленно. Например, разрежения и сжатия газа в звуковой волне, происходящие сотни раз в секунду, можно рассматривать как квазистатический процесс. Квазистатические процессы могут быть изображены на диаграмме состояний (например, в координатах p, V) в виде некоторой траектории, каждая точка которой представляет равновесное состояние.
Интерес представляют процессы, в которых один из параметров (давление, объем и термодинамическая температура) остается неизменным. Такие процессы называются изопроцессами.
Изотермический процесс –процесс изменения состояния газа при постоянной температуре: Τ = const. Для его осуществления надо сосуд с поршнем, наполненный газом, привести в контакт с термостатом, т.е. телом настолько большой массы, что она обеспечивает постоянство температуры газа, даже когда отдает газу или получает от него некоторое количество теплоты.
Из обобщенного газового закона:

при постоянной температуре получается зависимость
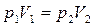 или
или  .
.
которая описывает закон Бойля-Мариотта: при постоянной температуре, неизменной массе и неизменном химическом составе газа произведение давления на объем есть величина постоянная.
Графики зависимости между параметрами данной массы при постоянной
 |
температуре называются изотермами. На рис. 1.1 изображены изотермы в координатах (p, V), (V, Τ), (p, Т).
Закон Бойля-Мариотта – один из основных газовых законов, открытый в 1662 году Робертом Бойлем (1627-1691) и независимо переоткрытый Эдмом Мариоттом (1620-1684) в 1676 году.
Важно уточнить, что в данном законе газ рассматривается, как идеальный. На самом деле, все газы в той или иной мере отличаются от идеального. Чем выше молярная масса газа, тем больше это отличие.
Изобарный процесс – процесс изменения состояния газа при постоянном давлении: p = const.
Количественное исследование зависимости объема газа от температуры при неизменном давлении было произведено в 1802 г. французским физиком и химиком Жозефом Луи Гей-Люссаком (1778-1850).
Из обобщенного газового закона

при постоянном давлении получается зависимость
 или
или 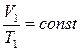 ,
,
которая описывает закон Гей-Люссака: объем данной массы газа при постоянном давлении и постоянном химическом составе прямо пропорционален абсолютной температуре.
Графики зависимости между параметрами газа при постоянной массе газа и давлении называют изобарами (рис. 1.2).
 |
Закон Гей-Люссака можно записать через температуру t, измеряемую по шкале Цельсия:
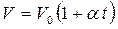 ,
,
где V 0 – объем газа при 0 °С, α = 1/273 К-1 – температурный коэффициент объемного расширения, оказавшийся одинаковым для всех газов.
Изохорный процесс – процесс изменения состояния газа при постоянном объеме: V = const. Экспериментальным путем зависимость давления газа от температуры при постоянном объёме установлена в 1787 году французским физиком Жаком Шарлем (1746-1823) и уточнена Ж.Л. Гей-Люссаком в 1802 году.
Из обобщенного газового закона

при постоянном объеме получается зависимость:
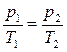 или
или  ,
,
которая описывает закон Шарля или второй закон Гей-Люссака: давление данной массы газа при постоянном объеме и постоянном химическом составе прямо пропорционально абсолютной температуре.
Закон Шарля или второй закон Гей-Люссака можно записать через температуру t, измеряемую по шкале Цельсия:
 ,
,
где р 0 – объем газа при 0 оС, β = 1/273 К-1 – температурный коэффициент давление, одинаковый для всех газов.
 |
Графики зависимости между параметрами газа при постоянной массе газа и постоянном объеме называют изохорами (рис. 1.3).
Закон Дальтона
Из истории науки. Английский физик и химик Джон Дальтон (1766- 1844) в 1793 г. опубликовал свой первый труд – «Метеорологические наблюдения и этюды», в котором содержатся зачатки его будущих открытий. Стремясь понять, почему газы в атмосфере составляют смесь с определенными физическими свойствами, а не располагаются друг над другом слоями в соответствии со своими плотностями, он установил, что поведение газа не зависит от состава смеси. Дальтон сформулировал закон парциальных давлений газов, а также обнаружил зависимость растворимости газов от их парциального давления. В 1802 г. Дальтон самостоятельно, независимо от Ж.Л. Гей-Люссака и Ж.Шарля, открыл один из газовых законов.
Парциальное давление (от лат. – частичный, часть) – давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре.
Для смеси идеальных газов выполняется закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений всех компонентов смеси:
 .
.
 2020-06-12
2020-06-12 964
964








