Пример 5. Выпадет ли осадок бромида серебра, если к 0,01М раствору соли Na[AgS2O3] добавить 0,001 моль бромида калия?
ПРAgBr = 5,38 · 10–13.
КН[ AgS2O3 ]=7,5·10-9
Решение:
Диссоциация комплексного иона: [AgS2O3]– ↔ Ag+ + S2O32–;
Кн = 
Примем концентрацию ионов серебра за х моль/л, концентрация
S2O32– х моль/л, концентрация комплексного иона
[AgS2O3]– = (0,01 – х) моль/л.
Кн=  ;
;  ; х=3,9·10-6 моль/л
; х=3,9·10-6 моль/л
Бромид калия — сильный электролит, концентрация ионов брома будет 0,001 моль/л. В данном растворе произведение ионов
[Ag+][Br]– = 3,9 · 10–6 · 10–3 = 3,9 · 10–9 больше, чем ПРAgBr, следовательно, осадок бромида серебра выпадет.
Ответ: осадок бромида серебра выпадет.
Пример 6. Вычислите растворимость хлорида серебра (моль/л, г/л)
в 1 л 0,1М раствора аммиака; ПР(AgCl) = 1,8 · 10–10.
Решение:
AgCl(ТВ) + 2NH3= [Ag(NH3)2]+ + Cl–; Константа равновесия этой реакции КР = 
Выразим концентрацию ионов хлора через ПР(AgCl): [Cl–] = 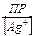 ,
,
подставим в выражение константы равновесия (КР). Получим:
КР = 
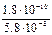 = 3,1 · 10–3.
= 3,1 · 10–3.
Кр = 3,1 · 10–3.
Если растворится х моль AgCl, то концентрация ионов хлора в растворе х моль/л, концентрация [Ag(NH3)2]+ х, концентрация аммиака (0,1 – х). Подставим эти значения в выражение Кр.
Кр. =  ,
,
поскольку х много меньше, чем 0,1, то этой величиной в разности можно пренебречь. Получим: 3,1 · 10–3 = 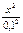
х = 5,6 · 10–3 — это количество моль AgCl, которое растворится в 1 л 0,1М раствора аммиака. Растворимость AgCl в г/л будет составлять:
5,6 · 10–3. 143,5 = 0,80 г.
Пример 7. Сколько л 1М раствора Na2S2O3 надо взять для полного растворения 0,1 г иодида серебра? ПРAgI = 8,30 · 10–17.
Решение:
Растворение иодида серебра можно представить:
AgI + S2O32–- = [AgS2O3]– + I–.
Кр =  = 5,5 · 10–8.
= 5,5 · 10–8.
Выразим количество моль иодида серебра, перешедшего в раствор через х, тогда [AgS2O3]– = [I–] = х, равновесная концентрация
[S2O32–] = (1 – х).
Кр =  ,
,
пренебрегая значением х в знаменателе, получим: 5,5 · 10–8 = х2.
х = 2,4 · 10–4 моль/л.
Следовательно, в 1 л 1М раствора Na2S2O3 растворяется 2,4 · 10–4 моль иодида серебра. Для растворения 0,10 г соли потребуется
 = 1,8 л раствора тиосульфата натрия.
= 1,8 л раствора тиосульфата натрия.
Контрольные вопросы
1. Дайте определения следующим понятиям:
§ комплексное соединение,
§ центральный атом (комплексообразователь), лиганд,
§ дентантность,
§ константа нестойкости и константа устойчивоcти комплексного иона. Разберите на конкретном примере
2. Приведите примеры комплексных соединений, являющихся солями, в состав которых входит:
§ комплексный анион,
§ комплексный катион.
3. Приведите примеры комплексных соединений, являющихся
§ кислотами,
§ основаниями.
4. В растворе присутствуют ионы Zn2+, аммиак и цианид-ионы. Какой лиганд образует с катионом цинка более прочное соединение?
5. По какому признаку комплексные соединения относят к хелатным?
6. Назовите перечисленные ниже соединения:
а) K2[Pb(OH)4]; б) Na3[Co(NO2)6]; в) [Co(NH3)6]Cl2.
Напишите уравнения диссоциации этих соединений в водном растворе. Приведите выражение константы нестойкости и его значение.
7. Какой аммиачный комплекс катионов VI аналитической группы наиболее прочный? Как можно разрушить этот комплекс? Ответ подтвердите соответствующими уравнениями реакций.
8. Могут ли реакции комплексообразования применяться для уменьшения токсического действия катионов тяжелых металлов? Приведите пример такой реакции комплексообразования для ионов: свинца (II), ртути (II), меди (II).
9. К какому типу комплексных соединений относится соединение Ni2+ с диметилглиоксимом? Приведите структурную формулу диметилглиоксима и уравнение реакции с катионом Ni2+.
10. Чему равны координационное число и дентантность лиганда в следующих координационных соединениях:
а) K2[Cd(CN)3Br];
б) K3[FeF4Cl2];
в) K2[Pt(OH)5Br];
г) [Cr(H20)5OH]NO3;
д) [Ni(NH3)6]SO4.
11. Приведите примеры использования реакции комплексообразования в анализе катионов V—VI аналитических групп с целью разделения этих катионов на группы.
12. Приведите примеры реакций разрушения аммиакатов для катионов VI аналитической группы.
13. Возможно ли обнаружение иона калия в присутствии иона аммония с реактивом Na3[Co(NO2)6]? Напишите соответствующие реакции ионов калия и аммония с данным реактивом.
14. Напишите реакцию обнаружения иона Со2+ с реактивом, содержащим ион SCN–. Почему эту реакцию выполняют капельным способом?
15. Катион Cu2+ можно открыть:
а) используя комплексное соединение как реагент;
б) используя реакцию комплексообразования с характерной окраской раствора.
Напишите эти реакции в молекулярном и ионном виде.
16. Как можно обнаружить катион Cd2+, используя комплексные соединение в качестве реагента? Что происходит с комплексным соединением в процессе реакции? Напишите соответствующую реакцию в молекулярном и ионном виде.
 2020-06-08
2020-06-08 1167
1167
