Реакции электрофильного замещения в ряду
Реакции электрофильного замещения характерны для ароматических, карбоциклических и гетероциклических систем. В результате делокализации p-электронов в молекуле бензола (и других ароматических систем) p-электронная плотность распределена равномерно по обе стороны цикла. Подобное экранирование p-электронами атомов углерода цикла защищает их от атаки нуклеофильными реагентами и, наоборот, облегчает возможность атаки электрофильными реагентами.
Но в отличие от реакций алкенов с электрофильными реагентами, взаимодействие ароматических соединений с ними не приводит к образованию продуктов присоединения, так как в этом случае нарушалась бы ароматичность соединения и уменьшалась его устойчивость. Сохранение ароматичности возможно в случае, если электрофильная частица заместит катион водорода.
Механизм реакций электрофильного замещения похож на механизм реакций электрофильного присоединения, так как имеются общие закономерности протекания реакций.
Общая схема механизма реакций электрофильного замещения SЕ:

На первом этапе реакции образуется p-комплекс с электрофильной частицей (быстрая стадия), который затем превращается в s-комплекс (медленная стадия) за счет образования s- связи одним из атомов углерода с электрофильной частицей. Для образования s- связи с электрофильной частицей из сопряжения «вырывается» пара электронов, а образующийся продукт приобретает положительный заряд. В s-комплексе ароматичность нарушена, так как один из атомов углерода находится в sp3-гибридизации, а на пяти других атомах углерода делокализованы четыре электрона и положительный заряд.
Для регенерации термодинамически выгодной ароматической системы происходит гетеролитический разрыв связи Csp3-Н. В результате отщепляется ион Н+, а пара электронов связи идет на восстановление системы сопряжения, при этом у атома углерода, отщепившего протон, изменяется гибридизация атомных орбиталей с sp3 на sp2. Механизм реакций нитрования, сульфирования, галогенирования, алкилирования, ацилирования ароматических соединений включает еще дополнительную стадию, не указанную в общей схеме – стадию генерирования электрофильной частицы.
Уравнение реакции нитрования бензола имеет вид:
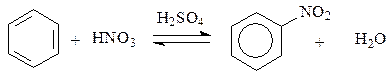
В реакциях нитрования генерирование электрофильной частицы происходит в результате взаимодействия азотной и серной кислот, что приводит к образованию катиона нитрония NO2+, который далее реагирует с ароматическим соединением:
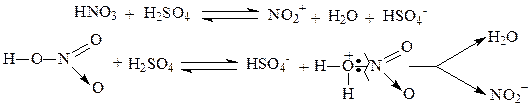
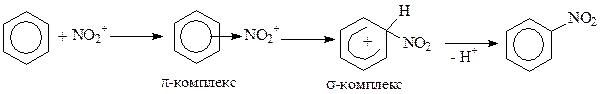
В молекуле бензола все атомы углерода равноценны, замещение происходит у одного из них. Если в молекуле присутствуют заместители, то реакционная способность и направление электрофильной атаки определяется природой этого заместителя. По влиянию на реакционную способность и на направление атаки все заместители делятся на две группы.
Ориентанты I рода. Эти заместители облегчают электрофильное замещение по сравнению с бензолом и направляют входящую группу в орто- и пара-положения. К ним относятся электронодонорные заместители, увеличивающие электронную плотность в бензольном ядре. В результате ее перераспределения в положения 2,4,6 (орто- и пара-положения) возникают частичные отрицательные заряды, что облегчает присоединение электрофильной частицы в эти положения с образованием s-комплекса.
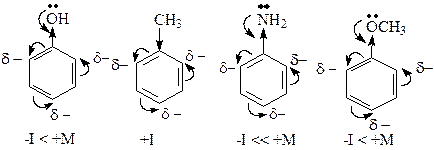
Ориентанты II рода. Эти заместители затрудняют реакции электрофильного замещения по сравнению с бензолом и направляют входящую группу в одно из мета-положений. К ним относятся электроноакцепторные заместители, уменьшающие электронную плотность в бензольном кольце. В результате ее перераспределения в положениях 3,5 (мета-положения) возникают частичные отрицательные заряды и присоединение электрофильной частицы с образованием s-комплекса идет в жестких условиях.
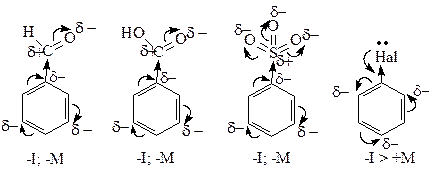
Атомы галогенов направляют электрофильную частицу в орто- или пара- положения (за счет положительного мезомерного эффекта), но при этом затрудняют протекание реакции, так как являются электроноакцепторными заместителями (-I>+M). Реакции галогенпроизводных бензола с электрофильными реагентами идут в жестких условиях.
В реакциях сульфирования роль электрофильной частицы выполняет молекула SO3, образующаяся в результате реакции: 2H2SO4 «SO3 +H3O+ + HSO4-. Атомы серы в этой молекуле характеризуются сильным дефицитом электронной плотности и наличием частичного положительного заряда и, следовательно, именно атом S должен, как электрофил, связываться с атомом углерода бензольного кольца толуола.
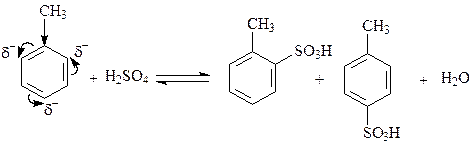
Метильная группа в толуоле является ориентантом первого рода, и как электронодонорный заместитель облегчает реакцию замещения и направляет входящую группу в орто- и пара-положения. На практике образуются продукты замещения и в мета-положении, но их количество существенно меньше количеств продуктов замещения в орто- пара-положения.
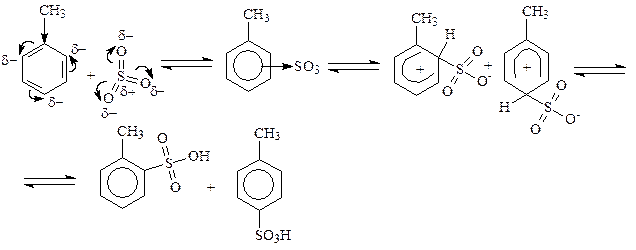
Галогенирование бензола и многих ароматических соединений действием самого галогена протекает только в присутствии катализаторов, таких как ZnCl2, AlCl3, FeBr3 и т.д. Катализаторами обычно являются кислоты Льюиса. Между атомом металла и атомом галогена образуется связь по донорно-акцепторному механизму, что вызывает поляризацию молекулы галогена, усиливая ее электрофильный характер. Полученный аддукт может подвергаться диссоциации с образованием комплексного аниона и катиона галогена, выступающего далее в качестве электрофильной частицы:
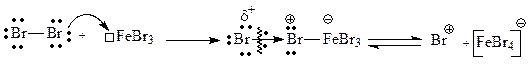
В качестве галогенирующих средств могут применяться также водные растворы НО-Hal в присутствии сильных кислот. Образование электрофильной частицы в этом случае можно объяснить следующими реакциями:
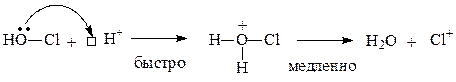
Механизм дальнейшего взаимодействия катионов Br+или Cl+ ничем не отличается от механизма нитрования катионами NO2+. Рассмотрим механизм реакции на примере бромирования анилина (ограничимся образованием монозамещенных продуктов). Как известно, анилин обесцечивает бромную воду, образуя в итоге 2,4,6-триброманилин, выделяющийся в виде белого осадка:
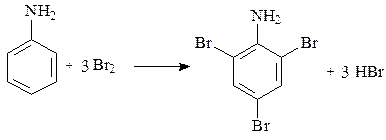
Генерирование электрофильной частицы:
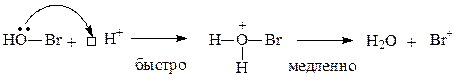
или:
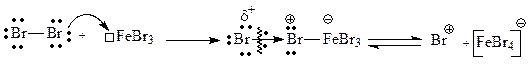
Образовавшаяся электрофильная частица атакует p-электроны бензольного кольца, образуя p-комплекс. Из возникшего p-комплекса образуются два основных s -комплекса, в которых связь углерод-бром возникает в орто- и пара-положениях цикла. На следующем этапе происходит отщепление протона, что приводит к образованию монозамещенных производных анилина. В избытке реагента эти процессы повторяются, приводя к образованию дибром- и трибромпроизводных анилина.
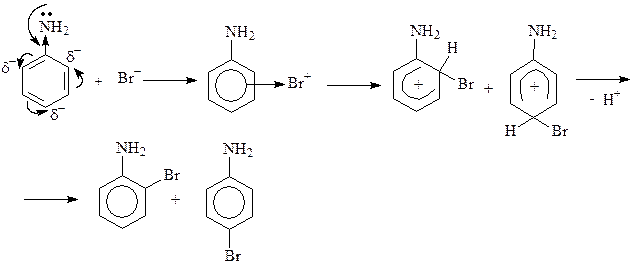 Алкилирование (замещение атома водорода на алкильный радикал) ароматических соединений осуществляется при их взаимодействии с галогеналканами (реакция Фриделя-Крафтса). Взаимодействие первичных алкилгалогенидов, например СН3Cl, с ароматическими соединениями в присутствии кислот Льюиса мало чем отличается по своему механизму от реакций галогенирования. Рассмотрим механизм на примере метилирования нитробензола. Нитрогруппа, как ориентант второго рода, дезактивирует бензольное кольцо в реакциях электрофильного замещения и направляет входящую группу в одно из мета-положений.
Алкилирование (замещение атома водорода на алкильный радикал) ароматических соединений осуществляется при их взаимодействии с галогеналканами (реакция Фриделя-Крафтса). Взаимодействие первичных алкилгалогенидов, например СН3Cl, с ароматическими соединениями в присутствии кислот Льюиса мало чем отличается по своему механизму от реакций галогенирования. Рассмотрим механизм на примере метилирования нитробензола. Нитрогруппа, как ориентант второго рода, дезактивирует бензольное кольцо в реакциях электрофильного замещения и направляет входящую группу в одно из мета-положений.
В общем виде уравнение реакции имеет вид:

Генерирование электрофильной частицы происходит в результате взаимодействия галогеналкана с кислотой Льюиса:
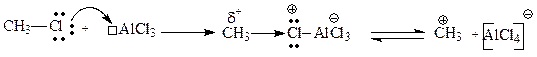
Образующийся метильный катион атакует p-электроны бензольного кольца, что приводит к образованию p-комплекса. Образовавшийся p-комплекс далее медленно превращается в s -комплекс (карбкатион), в котором связь между метильным катионом и атомом углерода цикла возникает главным образом в положениях 3 или 5 (т.е. в мета-положениях, в которых из-за электронных эффектов нитрогруппы возникают частичные отрицательные заряды). Завершающей стадией является отщепление протона от s -комплекса и восстановление сопряженной системы.

В качестве алкилирующих агентов при алкилировании бензола вместо алкилгалогенидов могут использоваться также алкены или спирты. Для образования электрофильной частицы – карбкатиона - необходимо наличие кислоты. Механизм реакции в этом случае будет отличаться лишь на стадии генерирования электрофильной частицы. Рассмотрим это на примере алкилирования бензола пропиленом и пропанолом-2:
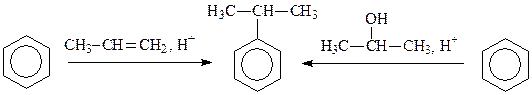
Генерирование электрофильной частицы:
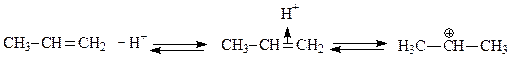
В случае использования в качестве реагента пропилена образование карбкатиона происходит в результате присоединения протона (по правилу Марковникова). При использовании в качестве реагента пропанола-2 образование карбкатиона происходит в результате отщепления молекулы воды от протонированного спирта.
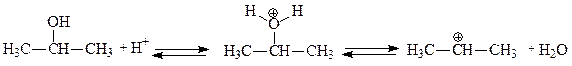
Образовавшийся изопропильный катион атакует p-электроны бензольного кольца, что приводит к возникновению p-комплекса, который далее превращается в s- комплекс с нарушенной ароматичностью. Последующее отщепление протона ведет к регенерации ароматической системы:
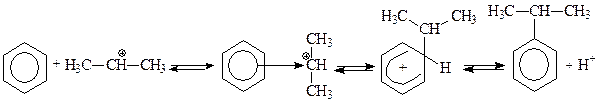
Реакции ацилирования (замещения катиона Н+ на ацильную группу R-C+=O) происходят аналогичным образом. Рассмотрим на примере реакции ацилирования метокисибензола, уравнение которой можно представить следующим образом:
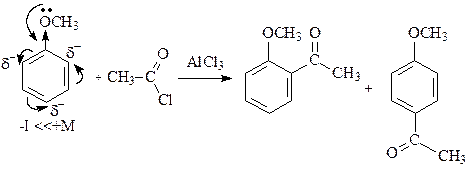
Как и в предыдущих случаях, электрофильная частица генерируется в результате взаимодействия хлорангидрида уксусной кислоты с кислотой Льюиса:
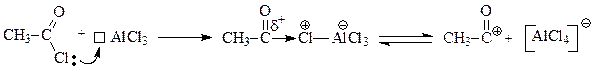
Образующийся катион ацилия сначала образует p-комплекс, из которого возникают главным образом два s -комплекса, в которых формирование s- связи между циклом и электрофильной частицей происходит преимущественно в орто- и пара-положениях, так как в этих положениях возникают частичные отрицательные заряды из-за электронного влияния метоксигруппы.
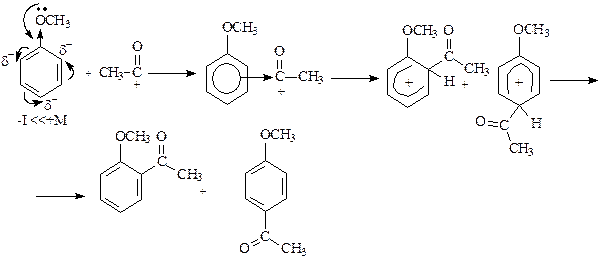
Ароматические гетероциклы также вступают в реакции электрофильного замещения. При этом пятичленные гетероциклы – пиррол, фуран и тиофен – легче вступают в реакции SE, так как являются p-избыточными системами. Однако при проведении реакций с этими соединениями необходимо учитывать их ацидофобность. Нестабильность этих соединений в кислой среде объясняется нарушением ароматичности в результате присоединения протона.
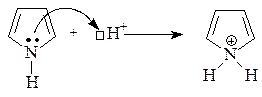
При проведении реакций электрофильная частица замещает протон в a-положении; если оба a-положения заняты, то замещение протекает по b-положению. В остальном механизм реакций электрофильного замещения аналогичен рассмотренным выше случаям. В качестве примера приведем бромирование пиррола:
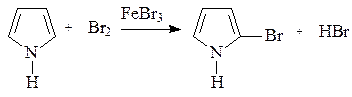
Механизм реакции с участием ароматических гетероциклов включает все рассмотренные выше стадии – генерирование электрофильной частицы, образование p-комплекса, превращение его в s- комплекс (карбкатион), отщепление протона, приводящее к образованию ароматического продукта.
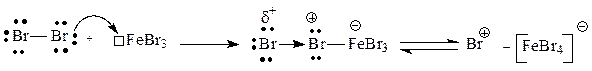
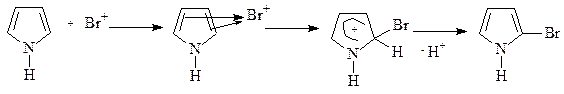
При проведении реакций электрофильного замещения с участием p-дефицитных ароматических систем, таких как пиридин и пиримидин, нужно учитывать их изначально более низкую реакционную способность (дефицит p-электронной плотности затрудняет образование p-комплекса и его превращение в s- комплекс), которая еще сильнее снижается при проведении реакций в кислой среде. Хотя в кислой среде ароматичность этих соединений не нарушается, протонирование атома азота приводит к усилению дефицита p-электронной плотности в цикле.
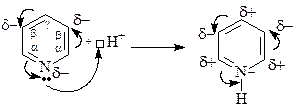
Пиридин способен алкилироваться, сульфироваться, нитроваться, ацилироваться и галогенироваться. Однако в большинстве случаев с электрофильной частицей образует связь более нуклеофильный атом азота, а не атомы углерода пиридина.
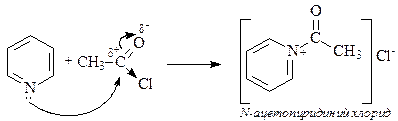
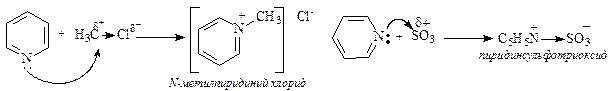
В случае протекания реакции в пиридиновом цикле замещение идет по одному из b-положений, в которых возникают частичные отрицательные заряды.
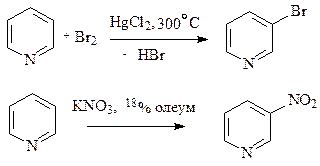
 2014-02-02
2014-02-02 22520
22520
