25. Основными параметрами состояния систем являются: ____________
26. В _ ___________ системах параметры не изменяются при отсутствии внешнего воздействия.
27. Процесс, который можно провести в прямом и обратном направлении через одни и те же стадии называется: _____________________________.
| 28. Формулировка первого закона термодинамики: ________________ |
29. В формуле Q = ∆U + A; ∆U - _______________________
30. Допишите формулу: Н = U +? ______________
31. Напишите формулу для расчета теплового эффекта (энтальпии) для химической реакции: N2(г)+ЗН2(г) ↔ 2NH3(г)
32. Напишите формулу для расчета теплового эффекта (энтальпии) для химической реакции:
2СН3ОН(ж) + ЗО2(Г)→2СО2(Г)+ 4Н2O(Ж)
| 33. В каком направлении будет смещаться равновесие (согласно принципу Ле-Шателье) для реакции 2SO2+O2↔2SO3 +Q при: А) повышении давления; Б) увеличении температуры; В) добавлении кислорода; Г) удалении продукта реакции |
34 Как сместится равновесие (согласно принципу Ле-Шателье), если мы уменьшим концентрацию NO2 в обратимой реакции: NO + O2 ↔ NO2 +Q.
А) не изменится;
Б) сместится в сторону продукта реакции.
В) сместится в сторону исходных веществ.
35. Как сместится равновесие (согласно принципу Ле-Шателье) в обратимой химической реакции
CH4↔ C2H2 + H2 – Q при:
А) понижении температуры
Б) повышении температуры
ЭКЗАМЕНАЦИОННЫЙ ТЕСТ
по дисциплине «Физическая и коллоидная химия»
Инструкция: вам предлагается тест, состоящий из 35 заданий. За каждый правильный ответ вы получаете по одному баллу. На выполнение работы отводится 120 минут.
Будьте внимательны и аккуратны при выполнении заданий, так как любое исправление равноценно ошибке. Успешной работы!
Шкала оценки образовательных достижений
| Процент результативности (правильных ответов) | Оценка уровня подготовки | ||
| балл (отметка) | вербальный аналог | ||
| 90 - 100 | 5 | отлично | |
| 80-89 | 4 | хорошо | |
| 70-79 | 3 | удовлетворительно | |
| менее 70 | 2 | неудовлетворительно | |
ВАРИАНТ 1
1. Сахарный сироп является системой:
A) гомогенной
Б) гетерогенной
B) закрытой
Г) изолированной
2.. Состояние системы может быть: __ равнн. и неравн. ________и ___________.
3. Если параметры системы изменяются при отсутствии внешнего воздействия, то система является: неравновесной.
4. Если при переходе системы из одного состояния в другое, сохраняется объем, процесс называется:
A) изотермическим
Б) адиабатическим
B) изохорным
Г) изобарным
5. Всякое изменение термодинамического состояния системы называется термодин.процессом
6. Форма передачи энергии путем неупорядоченного движения молекул:
А) теплота
Б) энергия
В) работа
Г) энтальпия
7. Изменение внутренней энергии системы___ не зависит ____________ от пути этого процесса.
8.. При изохорном процессе вся энергия расходуется на:
A) работу расширения
Б) изменение внутренней энергии
B) увеличение объема
9. Допишите формулу: Q =? + А .∆U
10. Количество теплоты, которое выделяется или поглощается при образовании 1 моль сложного вещества из простых веществ:
A) теплота разложения
Б) теплота сгорания
B) теплота образования
Г) теплота растворения
11. Формулировка основного закона термохимии (Гесса) _ тепловой эффект химической реакции не зависит от пути его протекания, а зависит от начального и конечного состояния исходных веществ и продуктов реакции
12.. Напишите формулу для расчета теплового эффекта (энтальпии) для химической реакции: 3NO2(г) + Н2O(Ж)→ 2НNO3(Ж) + NO(г)
∆Нх.р = (2Н°обрНNO3(ж)+ ∆Н°обрNO(г)) -(3∆H 0 o6pNO2(г) +∆Н°обрН2O(ж)
13. Мерой связанной энергии является___. энтропия __.
14. В ходе процессов сублимации, кипения, растворения энтропия:
А) увеличивается
Б) уменьшается
В) не изменяется
15. Система, состоящая из одной фазы:
A) изолированная
Б) гомогенная
B) гетерогенная
Г) открытая
16. Закончите определение: «Изохорным называется процесс, протекающий при постоянном......»
| А) | давлении |
| Б) | значении энтальпии |
| В) | количестве теплоты |
| Г) | объёме |
17. Как называется процесс, идущий при постоянном количестве теплоты?
| А) | адиабатическим |
| Б) | самопроизвольным |
| В) | изобарным |
| Г) | изотермическим |
18. Закончите определение: «Отношение количества поглощённой телом теплоты к изменению температуры, вызванному этим поглощением, называется ……»
| А) | теплотой растворения |
| Б) | энтропией |
| В) | тепловым эффектом |
19. В каком направлении возможно протекание обратимой химической реакции, если работа процесса отрицательна, а изменение энергии Гиббса положительно?
| А) | в обратном |
| b) | в прямом |
| в) | реакция невозможна |
20. Система, способная к обмену с окружающей средой только энергией, называется
| А) | открытой |
| Б) | изолированной |
| В) | закрытой |
| Г) | идеальной |
21. Выберите выражение, соответствующее тепловому эффекту эндотермических реакций:
| А) | 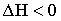 |
| Б) | 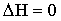 |
| В) | 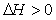 + + |
| Г) | 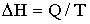 |
22. Выберите правильное соотношение между тепловыми эффектами реакции при постоянном давлении и при постоянном объёме:
| А) | D H = D UR - D nT |
| Б) | D H = D U + D nRT |
| В) | D H = D URT - D n |
23. Закончите формулировку: «Тепловой эффект химической реакции не зависит от пути процесса, а определяется только видом и состоянием ……»
| А) | исходных веществ |
| Б) | продуктов реакции |
| В) | исходных веществ и продуктов реакции |
24. Какие реакции называются обратимыми?
| А) | идущие с полным расходованием исходных веществ |
| Б) | идущие одновременно в обоих направлениях |
| В) | идущие с образованием газообразных веществ |
| Г) | идущие с образованием осадка |
25. Как изменится выход продуктов экзотермической обратимой реакции при охлаждении?
| А) | уменьшится |
| Б) | увеличится |
| В) | не изменится |
26. Как изменяется скорость химической реакции с понижением температуры?
| А) | не зависит |
| Б) | уменьшается |
| В) | увеличивается |
26. Вставьте пропущенное слово: «Количество теплоты, затрачиваемой на нагревание одного килограмма вещества на один градус, называется.... теплоёмкостью»
| А) | удельной |
| Б) | изохорной |
| В) | истинной |
| Г) | изобарной |
27. Укажите обозначение и размерность теплового эффекта (энтальпии) в системе СИ:
| А) | U, Дж/моль |
| Б) | Q, Дж |
| В) | G, кДж/моль |
| Г) | Н, Дж/моль |
28. Вставьте пропущенное выражение: «Энтропия изолированной системы возрастает в необратимом процессе и …… в обратимом процессе»
| А) | возрастает |
| Б | уменьшается |
| В) | не изменяется |
29. Вставьте пропущенное выражение: «Во всяком самопроизвольном процессе в изолированной системе энтропия при переходе от начального к конечному состоянию ……»
| А) | стремится к минимуму |
| Б) | уменьшается |
| В) | стремится к нулю |
| Г) | возрастает |
30. Вставьте пропущенное слово: «В присутствии ингибиторов скорость химической реакции................»
| А) | замедляется |
| Б) | увеличивается |
| В) | не изменяется |
31. Напишите формулу для расчета теплового эффекта (энтальпии) для химической реакции: F2O4(т) + 4СО(г) ↔ Fe(т) + 4СО(г).
.∆Нх.р = (Н°обр Fe(т) + 4∆Н°обрСO(г)) -(∆H 0 o6p F2O4(т) +4∆Н°обрСO(Г))
32. Какой прибор используется для определения тепловых эффектов химических реакций?
| А) | поляриметр |
| Б) | потенциометр |
| В) | калориметр |
| Г) | вискозиметр |
33. В каком направлении будет смещаться равновесие (согласно принципу Ле-Шателье) для реакции
N2+O2↔2NO – Q при:
А) повышении давления;
Б) увеличении температуры;
В) добавлении кислорода;
Г) удалении продукта реакции
34. С увеличением давления равновесие обратимой химической реакции, уравнение которой С2Н4(Г) + Н2О(Г) ↔ С2Н5ОН(Г):
А) не изменится;
Б) сместится в сторону продуктов реакции;
В) сместится в сторону исходных веществ.
35. Как сместится равновесие в обратимой химической реакции
NO2↔ NO + O2 при увеличении концентрации NO2
А) не изменится;
Б) сместится в сторону продукта реакции;
В) сместится в сторону исходных веществ.
 2020-06-10
2020-06-10 2837
2837







