| Общие сведения | ||
| Молекулярная формула С3Н8О3 или СН2OH–СНOH–СН2OH | Графическая формула
| Электронная формула
|
| Исторические сведения Впервые получен в 1779 году К.В. Шееле (Швеция) из продуктов гидролиза оливкового масла. | ||
| Нахождение в природе Входит в состав всех жиров и некоторых других веществ, образующих животные ткани. | ||
| *Получение 1) Образуется при брожении углеводов (например, глюкозы – С6Н12О6) и гидролизе жиров (как кислотном, так и щелочном) – уравнения не приводятся, вследствие их сложности. 2) СН2Cl–СНCl– СН2Cl +3NaOH | ||
| Физические свойства Бесцветная, вязкая, гигроскопичная (см. стр.) жидкость без запаха и со сладковатым привкусом. Не ядовита. Смешивается с водой в любых отношениях. Имеет высокую температуру кипения (tº = 290 ºC). | ||
| Химические свойства 1) 2СН2OH–СНOH–СН2OH + 6Na → 2СН2ONa–СНONa–СН2ONa + 3H2↑ замещение 2) 2С3Н8О3 + 7О2 3) СН2OH–СНOH–СН2OH+ 3HNO3 тринитрат глицерина («нитроглицерин») + 3H2O нитрование 4) С3Н8О3 + Cu(OH)2 → глицерат меди (II) – ярко-синий комплекс. Полное уравнение не приводятся, вследствие его сложности. | ||
| Применение Широко используется в кожевенной, текстильной, пищевой и кондитерской промышленностях, в парфюмерии и косметологии, как сырьё для получения лекарственных препаратов (например, 1 % раствор «нитроглицерина» используется, как сосудорасширяющее средство), взрывчатых веществ (например, динамита) и полимеров: лаков, красок, клеев. | ||
ОСНОВНЫЕ СВЕДЕНИЯ
ОБ УКСУСНОЙ КИСЛОТЕ
| Общие сведения | ||
| Молекулярная формула СН3COOH | Графическая формула
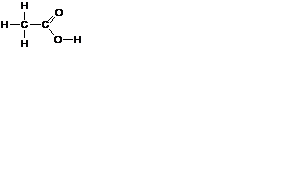
| Электронная
формула
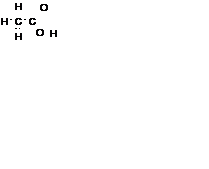
|
| Нахождение в природе Широко распространена в природе – содержится зелёных листьях растений, в выделениях животных (моче, желчи). Образуется при окислении многих органических веществ, а также при брожении, гниении, скисании вина и пива, содержится в кислом молоке и сыре. | ||
| *Получение 1) С4Н10 + 4[O] 2) С2H5OH + 2[O] 3) СH3CHO + [O] 4) CH3COONa + H2SO4(конц.) | ||
| Физические свойства Безводная уксусная кислота представляет собой бесцветную кристаллическую массу, напоминающую лёд, поэтому ее называют «ледяной» (впервые получена в 1789 году Т.Е. Ловицем (Россия)). Обычная техническая кислота – представляет бесцветную легкоподвижную жидкость с резким специфическим запахом, отлично растворимую в воде. 70-80 % раствор называют уксусной эссенцией, а 3-9 % раствор пищевым уксусом. | ||
| Химические свойства 1) 2CH3COOH + Zn → (CH3COO)2Zn + H2↑ замещение 2) 2CH3COOH + ZnO → (CH3COO)2Zn + H2O обмен 3) CH3COOH + NaOH → CH3COONa + H2O обмен 4) 2CH3COOH + Na2CO3 → 2CH3COONa + CO2↑ + H2O обмен с разложением 5) CH3COOH + C2H5ОН | ||
| Применение Широко используется в химической промышленности для получения солей – ацетатов, сложных эфиров (например, этилацетата), уксусного ангидрида, лекарственных препаратов, различных полимеров, ядохимикатов, а также в пищевой и консервной промышленностях. | ||
 2020-06-08
2020-06-08 192
192

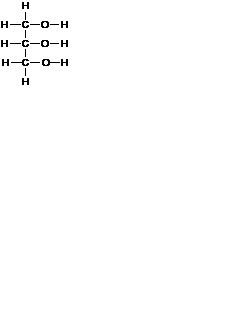
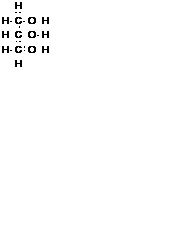
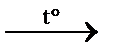 СН2OH–СНOH–СН2OH +3NaCl
СН2OH–СНOH–СН2OH +3NaCl 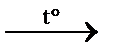 6CО2↑ + 8Н2О горение
6CО2↑ + 8Н2О горение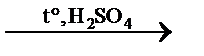 СН2ONO2–СНONO2–СН2ONO2 +
СН2ONO2–СНONO2–СН2ONO2 +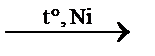 2CH3COOH окисление бутана
2CH3COOH окисление бутана






