Энергия Гиббса (G) является критерием самопроизвольного протекания процесса.
Энергия Гиббса – это функция состояния системы, изменение которой равно максимальной полезной работе системы.
По IIзакону термодинамик – в изолированных системах процессы протекают самопроизвольно в направлении увеличения энергии – энергия Гиббса в самопроизвольных процессах уменьшается.
∆Gможно рассчитать, как: 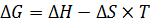 , так и:
, так и: 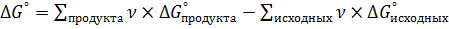 .
.
Например: При Т=727°C, т.е Т=1000К, химическая реакция проходит с энтальпией равной 175 кДж и с энтропией равной Т=253 Дж/К рассчитываем ∆G: 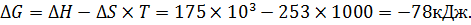 При реакции:
При реакции: 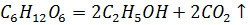 рассчитываем ∆G°при ∆G(
рассчитываем ∆G°при ∆G(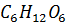 )=-911 кДж, а ∆G(
)=-911 кДж, а ∆G(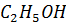 )=-174 кДж и ∆G(
)=-174 кДж и ∆G(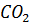 )=-394,4 кДж:
)=-394,4 кДж: 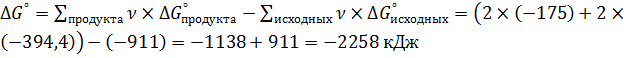
4) Определите Кравн системы 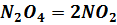 , если концентрация
, если концентрация 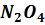 равна 0,02 моль/дм3 и диссоциация в момент равновесия равна 60%.
равна 0,02 моль/дм3 и диссоциация в момент равновесия равна 60%.
Дано:
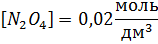
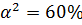
Решение:
Кравн такая же как Кион, т.е. равна ей. Значит 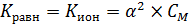 . Находим по этой формуле Кравн:
. Находим по этой формуле Кравн: 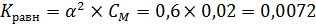
Билет№25.
2. Соединения серы(VΙ)
Соединения серы со степенью окисления +6.
Оксид серы (VI) SO3. Известен в трех модификациях: a, b, g. При конденсации паров SO3 образуется бесцветные, прозрачные как лед кристаллы (tпл=62оС), это g-форма, которая при хранении переходит в b-форму, похожую на асбест (tпл=32оС). a-форма (tпл=17оС, tкип=44,8оС) образуется при особых условиях. Из этих трех форм наиболее высоким давлением пара обладает g-форма. Полученный серный ангидрид может быть твердым или частично жидким. Жадно соединяясь с водой, дымит на воздухе. В воде он растворяется с образованием серной кислоты. Образует соединения с водой, аммиаком или его органическими производными. Получают окислением сернистого газа.
Серная кислота H2SO4. Безводная серная кислота - бесцветная маслянистая жидкость, без запаха. tпл=10оС, tкип=296оС. Концентрированная серная кислота вызывает ожоги кожи. Серная кислота может быть различной чистоты и концентрации. Плотность увеличивается с концентрацией и достигает максимального значения при концентрации 98,3%, при дальнейшем повышении концентрации плотность кислоты снижается. Растворение в воде сопровождается выделением большого количества тепла и уменьшением объема. При давлении 760 мм рт. ст. все водные растворы кипят при температуре выше 100оС, точка кипения повышается с увеличением концентрации. Мало летуча. Концентрированная серная кислота действует почти на все металлы без выделения водорода. Молярная электропроводность при бесконечном разведении при 25оС равна 859,6 Cм.см2/моль [4]. Для промышленного получения применяются два способа: нитрозный и контактный. Основным исходным продуктом в обоих случаях является сернистый газ. Является важнейшим химическим продуктом. Она применяется почти во всех отраслях химической промышленности и в целом ряде других отраслей народного хозяйства.
Хлористый сульфурил SO2Cl2. Представляет собой бесцветную жидкость с резким запахом. tпл=-54оС [1], tкип=69оС [1]. Холодная вода действует на него лишь медленно, но горячей он быстро разлагается с образованием серной и соляной кислот.
А так же соединения состава SO2Hal2 SF6
3. Как получить комплексы меди (Ι) и (ΙΙ)?
Для меди (II) характерны катионные и анионные комплексы, при растворении солей меди (II) в воде или при взаимодействии оксида гидроксида меди (II) с кислотами образуются голубые аквакомплексы [Cu(H2O)6]2+. Аммиачные комплексы образуются при действии аммиака на растворы солей меди (II):
CuSO4 + 4NH3 = [Cu(NH3)4]SO4.
Анионные комплексы получаются при растворении гидроксида меди (II) в концентрированных растворах щелочей, при этом образуются синие гидроксокупраты:
Cu(OH)2 + 2NaOH = Na2[Cu(OH)4].
В избытке основных галогенидов образуются галогенокупраты (II):
CuCl2 + 2NaCl = Na2[CuCl4].
Анионные комплексы меди (II) известны также с карбонат- и сульфат-ионами.
Для меди (I) аквакомплексы неустойчивы, устойчивы амминокомплексы типа [Cu(NH3)2]+, гидроксокомплексы [Cu(OH)2]- и хлоридные комплексы [CuCl2]-.
Комплексообразование имеет большое значение при переводе металла в раствор:
2Cu + 8NH3 + 2H2O + O2 = 2[Cu(NH3)4](OH)2.
Билет №26
Понятие об энтропии, как мере неупорядоченности системы.
Энтропия отражает движение частиц вещества, она возрастает с увлечением движения частиц (при нагревании, испарении, плавлении) и уменьшается в процессе, связанных с упорядоченностью системы (при кристаллизации, конденсации, сжатии).
Энтропия является функцией состояния, т.е. ее изменение (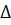 S) зависти только от начального (S1)и конечного(S2)состояния и не зависит от пути процесса:
S) зависти только от начального (S1)и конечного(S2)состояния и не зависит от пути процесса: 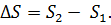
Железо, химическая активность. Соединения железа (II) и железа (III). Гидролиз солей железа.
Feнаходится в VIIbгруппе 4 периоде. Обычно имеет степени окисления, равные +2 и +3, но высшая степень окисления все-таки +6.
Железо реагирует с водой только при нагревании выше 500°C: 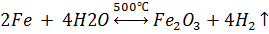 .
.
Кислоты-окислители при нагревании окисляют Feдо Fe (III): 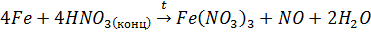
При действии разбавленной азотной кислоты Feокисляется доFe (III): 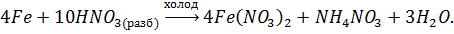
Соединения железа (II):
FeO, Fe(OH)2 – имеют основный характер:
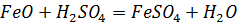
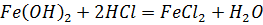
Соли гидролизуются по катиону, при этом раствор имеет кислую среду:
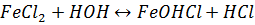
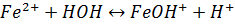
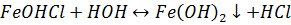
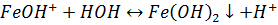
Соединения железа (III):
Fe2O3, Fe(OH)3 – имеют амфотерные свойства:
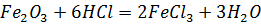
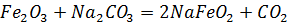
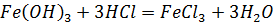
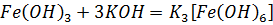
Соли гидролизуются по катиону, при этом раствор имеет кислую среду:
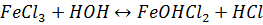
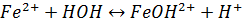
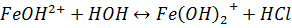
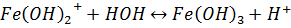
Как можно получить тиосульфат натрия? Восстановительные свойства тиосульфата.
Можно получить путем взаимодействия 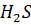 и
и 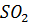 с
с 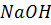 :
: 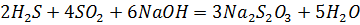
Тиосульфат натрия проявляет восстановительные свойства с сильными окислителями, при этом окисляется до сульфатов или серной кислоты:
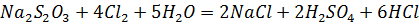
Более слабыми окислителями до солей тетратионовой кислоты: 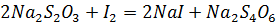
Задача
В 1300 воды растворено 180 г соды. Определите T, ω,моляльность, С(х) и молярную концентрацию эквивалентов, если р=1.16 г/см3.
Дано:
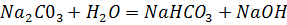
m(H2O)=1300 г
m(Na2CO3)=108 г
р=1,16 г/моль
Найти T, моляльность, C(x) и молярную концентрацию эквивалентов?
Решение:
Пишем уравнению реакции:
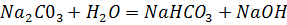
Mr(H2O)=18г/моль
Mr(Na2CO3)=106 г/моль
Карбонат натрия будет в недостатке, т.к. υ(H2O)= 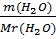 =72,2мольбольше чем υ(Na2CO3)=
=72,2мольбольше чем υ(Na2CO3)= 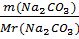 = 1,02моль.
= 1,02моль.
Находим общую массу карбоната натрия - 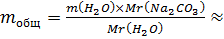 7656 г
7656 г
Из этой общей массы прореагировала только 180 г карбоната натрия.
Реакция проходит при нормальных условиях, т.е. при давлении равном 100 кПа.
Находим температуру через уравнение Менделя-Клапейрона:
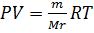 отсюда выражаем и находим температуру.
отсюда выражаем и находим температуру.
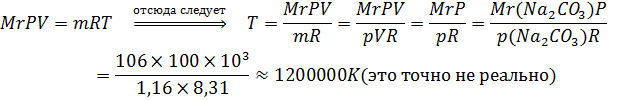
Находим массовую долю:
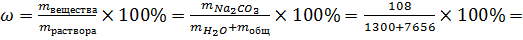 1,2%(опять что то непонятное)
1,2%(опять что то непонятное)
Находим моляльность:
 2020-07-12
2020-07-12 1382
1382








