1 Найти молярную массу воздуха, считая, что он состоит по массе из одной части кислорода и трех частей азота.
Решение
Воздух, являясь смесью идеальных газов, тоже представляет идеальный газ, и к нему можно применить уравнение Клапейрона - Менделеева
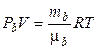 . (1.1)
. (1.1)
Для каждой компоненты смеси кислорода и азота запишем соответствующее уравнение:
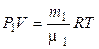 , (1.2)
, (1.2)
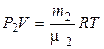 , (1.3)
, (1.3)
где P 1 и P 2 – парциальные давления кислорода и азота.
По закону Дальтона Pb = P 1 + P 2. Складываем (1.2) и (1.3), получим
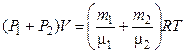 , (1.4)
, (1.4)
или на основании закона Дальтона
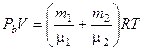 . (1.5)
. (1.5)
Сравнивая (1.1) и (1.5) и учитывая, что mb = m 1 + m 2, имеем
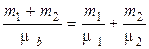 ,
,
откуда 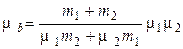 (1.6)
(1.6)
Подставляя в (1.6) m 2 = 3 m 1(по условию), найдем молярную массу воздуха
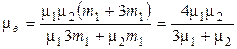 ,
,
где m1 = 32×10-3 кг/моль; m2 = 28×10-3 кг/моль. Подставляя численные значения, получим m = 29×10-3 кг/моль.
2 Определить долю молекул водорода, модули скоростей которых при температуре 27°С лежат в интервале от 1898 м/с до 1902 м/с.
Решение
В данной задаче удобнее воспользоваться распределением молекул по относительным скоростям. Доля молекул 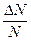 , относительные скорости которых заключены в интервале от u до
, относительные скорости которых заключены в интервале от u до 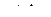 , определяется формулой
, определяется формулой
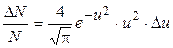 , (2.1)
, (2.1)
где 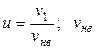 – наиболее вероятная скорость;
– наиболее вероятная скорость; 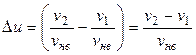 .
.
С учетом этих выражений формула (2.1) примет вид
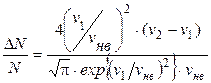 .
.
Для удобства сначала вычислим 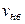
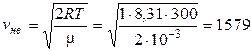 (м/с)
(м/с)
и отношение скоростей 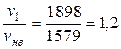 .
.
Подставим численные значения в (2.1) и найдем долю молекул водорода, модули скоростей которых лежат в интервале от v 1 до v 2
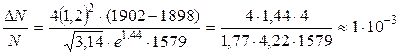 .
.
3 6,5 г водорода, находящегося при температуре 27°С, расширяется вдвое при Р = const за счет притока тепла извне. Найти: 1) работу расширения; 2)изменение внутренней энергии; 3) количество теплоты, сообщенное газу.
Решение
Приступая к решению задачи, прежде всего надо выявить характер процесса, протекающего в газе, и использовать соответствующие формулы из таблицы 1.
1Вычислим значения молярных теплоемкостей водорода, учитывая, что молекулы водорода двухатомные и число степеней свободы i = 5:
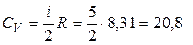 Дж/(моль К),
Дж/(моль К),
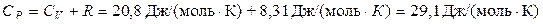 .
.
2Используя условие задачи и уравнение для изобарического процесса 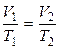 , найдем температуру газа после расширения:
, найдем температуру газа после расширения:
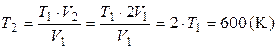 .
.
3 Вычислим изменение внутренней энергии и количество теплоты:
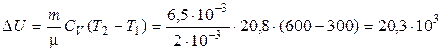 (Дж),
(Дж),
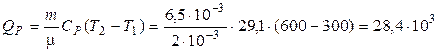 (Дж).
(Дж).
4 На основании первого начала термодинамики найдем работу расширения газа
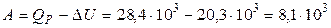 (Дж).
(Дж).
4 Двухатомный идеальный газ, занимающий при давлении Р 1 = 3×105 Па объем V 1= 4 л, расширяется до объема V 2= 6 л, при этом давление падает до  значения Р 2 = 105 Па. Процесс происходит сначала по адиабате, затем по изохоре. Определить работу сил давления газа, изменение его внутренней энергии и количество поглощенной теплоты при этом переходе.
значения Р 2 = 105 Па. Процесс происходит сначала по адиабате, затем по изохоре. Определить работу сил давления газа, изменение его внутренней энергии и количество поглощенной теплоты при этом переходе.
Решение
1 Газ участвует в двух процессах: а) адиабатное расширение из состояния 1 в некоторое состояние x, в котором объем
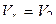 , (4.1)
, (4.1)
давление Px неизвестно; б) изохорический процесс из состояния x в состояние 2. Найдем Px из уравнения адиабаты для двух состояний
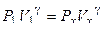 . (4.2)
. (4.2)
Для двухатомного газа i = 5, следовательно
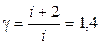 . (4.3)
. (4.3)
Значение Рх получим на основании (4.1), (4.2) и (4.3), а именно
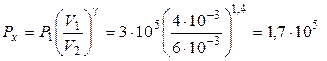 (Па).
(Па).
Откуда видим, что 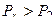 , и процесс 1-2 можно представить графически, как показано на рисунке.
, и процесс 1-2 можно представить графически, как показано на рисунке.
Учтем, что 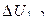 не зависит от вида процесса, а зависит только от начального и конечного состояний. Следовательно,
не зависит от вида процесса, а зависит только от начального и конечного состояний. Следовательно,
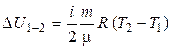 .
.
Из уравнения Клапейрона - Менделеева для состояний 1 и 2 имеем
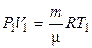 и
и 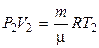 ,
,
откуда получим
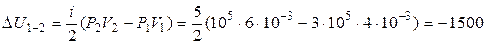 (Дж),
(Дж),
а это значит, что газ охлаждается.
2 Работа А 1-2 есть сумма работ: 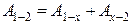 , где для изохоры х –2: Аx –2 = 0, для адиабаты 1– х:
, где для изохоры х –2: Аx –2 = 0, для адиабаты 1– х:
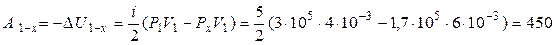 (Дж),
(Дж),
т.е. 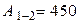 (Дж).
(Дж).
3 Количество теплоты Q 1−2 складывается также как сумма теплот: 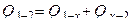 , где для адиабаты Q 1– x = 0 (табл.1), для изохоры х –2:
, где для адиабаты Q 1– x = 0 (табл.1), для изохоры х –2:
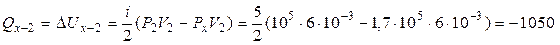 (Дж),
(Дж),
т.е. 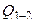 = – 1050 Дж, а это значит, что газ отдает тепло.
= – 1050 Дж, а это значит, что газ отдает тепло.
5 Кислород массой 0,2 кг нагревают от температуры 27°Сдо 127°С. Найти изменение энтропии, если известно, что начальное и конечное давление газа одинаковы.
Решение
Энтропия является функцией состояния термодинамической системы, изменение которой в случае обратимого процесса равно приведенной теплоте процесса, т.е.
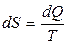 ,
,
или в интегральной форме 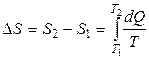 .
.
В нашем случае совершается обратимый изобарический процесс, для которого количество тепла при нагревании может быть найдено по формуле
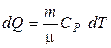 .
.
Подставляя 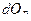 в подинтегральное выражение, получим
в подинтегральное выражение, получим
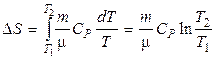 .
.
Используя формулу теплоемкости 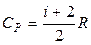 , где i = 5, получим
, где i = 5, получим
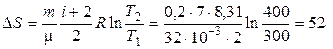 (Дж/К).
(Дж/К).
 2020-07-12
2020-07-12 453
453








