| Элемент | Связь Э=Э | Энергия | Связь Э- Э- Э | Энергия |
| Кислород | О=О | 493.6 | О-О-О | 146х2=292 |
| Сера | S=S | 421.3 | S-S-S | 265х2=530 |
Из приведенных значений следует, что образование двух одинарных  -связей для серы вместо одной двойной (
-связей для серы вместо одной двойной ( +
+  ) связано с выигрышем в энергии (530 - 421 = 109 Дж/моль). Для кислорода, напротив, одна двойная связь энергетически предпочтительнее (494-292=202 кДж/моль), чем две одинарные. Уменьшение прочности двойной связи при переходе от О к S связано с увеличением размеров р-орбиталей и уменьшением их перекрывания. Таким образом для кислорода катенация ограничивается небольшим числом нестойких соединений: O3 озон, O4F2.
) связано с выигрышем в энергии (530 - 421 = 109 Дж/моль). Для кислорода, напротив, одна двойная связь энергетически предпочтительнее (494-292=202 кДж/моль), чем две одинарные. Уменьшение прочности двойной связи при переходе от О к S связано с увеличением размеров р-орбиталей и уменьшением их перекрывания. Таким образом для кислорода катенация ограничивается небольшим числом нестойких соединений: O3 озон, O4F2.
Более ярко катенация наблюдается у серы, селена и теллура. Для них известны многочисленные линейные и циклические молекулярные формы, образованные цепочками - Э- Э-. Методами хроматографии идентифицированы циклы Sn, где 6  n
n  23. Бесконечные цепи Эn обнаружены для серы, селена, теллура.
23. Бесконечные цепи Эn обнаружены для серы, селена, теллура.
Катенация не ограничивается простыми веществами. Известны соединения, содержащие гомоатомные циклы и цепи, стабилизированные концевыми - H, - Cl или группами -  , например:
, например:
| полисульфаны | (0<n  6): 6): |  |
| дихлорполисульфаны | (O < n  100): 100): | 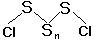 |
| политионаты | (1  n n  22): и т.д. 22): и т.д. |  |
| циклические поликатионы |  . . |
С катенацией сязаны аллотропия и полиморфизм простых веществ. Аллотропия - это способность одного и того же элемента существовать в разных молекулярных формах. Явление аллотропии относят к молекулам, содержащим разное количество атомов одного и того же элемента, например, О2 и О3, S2 и S8, Р2 и Р4 и т.д. Понятие полиморфизма относится только к твердым веществам. Полиморфизм - способность твердого вещества с одним и тем же составом иметь разное пространственное строение. Примерами полиморфных модификаций являются сера моноклинная и сера ромбическая, состоящие из одинаковых циклов S8, но размещенных в пространстве по-разному (см. § 2.3). Рассмотрим сначала свойства кислорода и его аллотропной формы - озона, а затем полиморфизм серы, селена и теллура.
§ 2.2. Кислород, озон: строение и свойства.
Кислород - самый распространенный элемент на Земле. Известно около 1500 минералов, содержащих кислород. Вследствие жесткости электронной оболочки для кислорода характерны слабое межмолекулярное взаимодействие и низкие температуры плавления и кипения (табл.2).
При 20оС растворимость О2 составляет 3.08 объема в 100 объемах воды. Растворимость в соленой воде несколько ниже, но достаточна для поддержания жизни в морях. Растворимость О2 в органических жидкостях на порядок выше.
Электронное строение молекулы О2 описывается на основе метода МО (рис.1а).
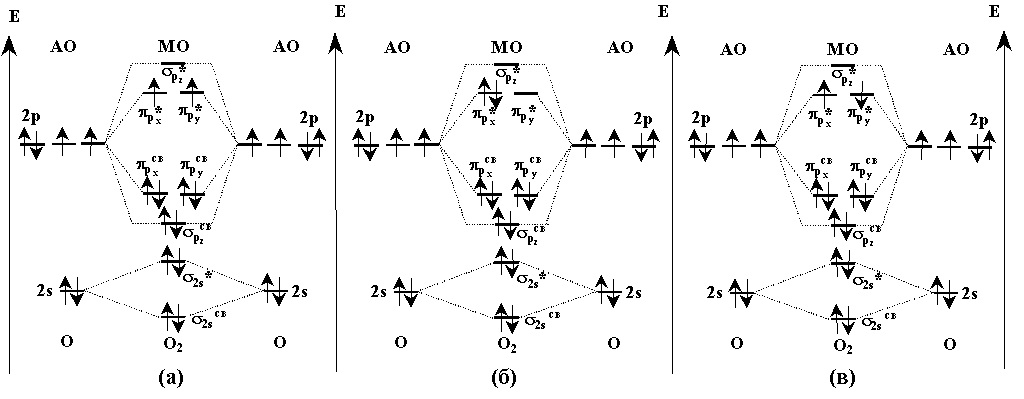
Рис.1. Схема молекулярных орбиталей молекулы кислорода в основном (а) и двух возбужденных состояниях (б) и (в).
На этой схеме по краям нанесены энергии атомных орбиталей (АО), а в середине - молекулярных (МО). Взаимодействующие атомные и образующиеся молекулярные орбитали соединены пунктирными линиями. Две нижние по энергии 2s- АО порождают две нижние связывающую  и разрыхляющую
и разрыхляющую 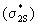 МО. Самой нижней по энергии молекулярной орбиталью, образуемой двумя наборами трижды вырожденных р-орбиталей, является связывающая связывающая
МО. Самой нижней по энергии молекулярной орбиталью, образуемой двумя наборами трижды вырожденных р-орбиталей, является связывающая связывающая  орбиталь, поскольку
орбиталь, поскольку  -перекрывание pz- pz АО больше, чем
-перекрывание pz- pz АО больше, чем  и
и  . Соответственно наибольшее расщепление уровней приводит к тому, что самой верхней по энергии является разрыхляющая
. Соответственно наибольшее расщепление уровней приводит к тому, что самой верхней по энергии является разрыхляющая  орбиталь. Между
орбиталь. Между  связывающей и
связывающей и  разрыхляющей орбиталями находятся
разрыхляющей орбиталями находятся  и
и  связывающие и
связывающие и  ,
,  разрыхляющие МО.
разрыхляющие МО.  -молекулярные орбитали дважды вырождены, так как перекрывание рх и рy АО совершенно одинаково. По сравнению с азотом энергия
-молекулярные орбитали дважды вырождены, так как перекрывание рх и рy АО совершенно одинаково. По сравнению с азотом энергия  МО оказывается ниже, чем энергия
МО оказывается ниже, чем энергия 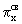 и
и  МО. Это обусловлено увеличением различия энергий 2s- и 2р- АО у кислорода и уменьшением взаимодействия однотипных
МО. Это обусловлено увеличением различия энергий 2s- и 2р- АО у кислорода и уменьшением взаимодействия однотипных  и
и  связывающих молекулярных орбиталей. Наличие двух неспаренных электронов с параллельными спинами на дважды вырожденных разрыхляющих
связывающих молекулярных орбиталей. Наличие двух неспаренных электронов с параллельными спинами на дважды вырожденных разрыхляющих  *-орбиталях объясняет парамагнетизм кислорода. Такое расположение электронов соответствует триплетному состоянию с межатомным расстоянием О-О 1.2074
*-орбиталях объясняет парамагнетизм кислорода. Такое расположение электронов соответствует триплетному состоянию с межатомным расстоянием О-О 1.2074 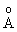 . Поскольку на связывающих орбиталях молекулы находится на 4 электрона больше, чем на разрыхляющих, формально можно считать в молекуле О2 связь между атомами двойной.
. Поскольку на связывающих орбиталях молекулы находится на 4 электрона больше, чем на разрыхляющих, формально можно считать в молекуле О2 связь между атомами двойной.
Если при фотохимическом или химическом возбуждении на одной  *-орбитали оказываются два электрона с противоположными спинами, то возникает так называемое синглетное состояние с общим нулевым спином (рис.1б). Это состояние по энергии расположено на 92 кДж/моль выше основного состояния. Если же при возбуждении атома кислорода два электрона занимают разные
*-орбитали оказываются два электрона с противоположными спинами, то возникает так называемое синглетное состояние с общим нулевым спином (рис.1б). Это состояние по энергии расположено на 92 кДж/моль выше основного состояния. Если же при возбуждении атома кислорода два электрона занимают разные  *-орбитали и имеют противоположные спины, то возникает еще одно возбужденное синглетное состояние с нулевым спином (рис.1в).
*-орбитали и имеют противоположные спины, то возникает еще одно возбужденное синглетное состояние с нулевым спином (рис.1в).
Оно лежит на 155 кДж/моль выше основного состояния молекулы О2. Возбуждение сопровождается увеличением межатомных расстояний О- О: от 1.2074 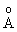 до 1.2155
до 1.2155 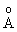 у первого (рис.1б) и до 1.2277
у первого (рис.1б) и до 1.2277 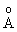 у второго (рис.1в) возбужденного состояния, что, в свою очередь, приводит к ослаблению связей О- О и к повышению химической активности кислорода. Поэтому оба синглетные состояния молекулы О2 играют важную роль в реакциях окисления в газовой фазе. Поглощение в видимой части спектра (красная-желтая-зеленая) обеспечивает голубой цвет жидкого О2 в возбужденном состоянии.
у второго (рис.1в) возбужденного состояния, что, в свою очередь, приводит к ослаблению связей О- О и к повышению химической активности кислорода. Поэтому оба синглетные состояния молекулы О2 играют важную роль в реакциях окисления в газовой фазе. Поглощение в видимой части спектра (красная-желтая-зеленая) обеспечивает голубой цвет жидкого О2 в возбужденном состоянии.
В ряду N2- O2- F2 энергии диссоциации (атомизации) равны 945.4, 493.8 и 158.8 кДж/моль, соответственно. Ослабление прочности молекул приводит к резкому усилению химической активности от азота к кислороду и особенно к фтору. Многие реакции кислорода и фтора экзотермические и протекают самопроизвольно.
Степени окисления кислорода в его соединениях могут изменяться в широких границах: +1/2(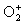 ), О(О3), -1/3(
), О(О3), -1/3(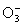 ), -1/2(
), -1/2( ), -1(
), -1( ) и -2(О2- ). Координационные числа атома кислорода в соединениях также весьма разнообразны: от О (атомарный кислород), 1 (О2, СО), 2 (Н2О, Н2О2), 3 (Н3О+) до 4 (оксиацетаты Be и Zn), 6 (МgO, CdO) и 8 (Na2O, Cs2O).
) и -2(О2- ). Координационные числа атома кислорода в соединениях также весьма разнообразны: от О (атомарный кислород), 1 (О2, СО), 2 (Н2О, Н2О2), 3 (Н3О+) до 4 (оксиацетаты Be и Zn), 6 (МgO, CdO) и 8 (Na2O, Cs2O).
Рассмотрим особенности строения и свойств озона. Наличие трех атомов кислорода в молекуле озона О3 приводит к существенному изменению прочности связи и свойств по сравнению с кислородом О2. Озон получают действием электрического разряда на кислород, при газовых разрядах, под действием ультрафиолетового излучения.
Диамагнитная молекула О3 изогнутая: валентный угол О- О- О равен 116.8о, расстояние между центральным и концевыми атомами О равно 1.278 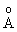 . Это расстояние меньше длины одинарной связи (1.49
. Это расстояние меньше длины одинарной связи (1.49 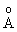 в Н2О2) и больше длины двойной связи (1.21
в Н2О2) и больше длины двойной связи (1.21 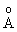 в О2).
в О2).
Каждый атом O образует одну 1  -связь с соседним атомом за счет р-электрона. Остальные р-орбитали комбинируются с образованием одной несвязывающей и одной разрыхляющей орбиталей. Количество электронов точно соответствует заселению связывающей и несвязывающей МО. Поэтому электронную систему озона относят к четырехэлектронным трехцентровым связям. Общий порядок каждой связи О- О около 1.5: 1
-связь с соседним атомом за счет р-электрона. Остальные р-орбитали комбинируются с образованием одной несвязывающей и одной разрыхляющей орбиталей. Количество электронов точно соответствует заселению связывающей и несвязывающей МО. Поэтому электронную систему озона относят к четырехэлектронным трехцентровым связям. Общий порядок каждой связи О- О около 1.5: 1  -связывающей и 0.5
-связывающей и 0.5  -несвязывающей МО.
-несвязывающей МО.
В кислой и щелочной средах озон - более сильный окислитель, чем кислород;:
 | Ео = +2.076 В |
 | Ео = +1.24 В. |
| Примеры окислительных реакций озона: | |
|
| |
|
| |
|
| |
Восстановительными свойствами озон не обладает. Таким образом, озон характеризуется свойствами сильного окислителя и переносчика атома О с выделением свободного О2. К числу характерных реакций озона относится образование озонидов щелочных МО3 и щелочно-земельных М(О3)2 металлов при пропускании озона в щелочные растворы. Термическая устойчивость озонидов МО3 в ряду Na<K<Rb<Cs и М(О3)2 в ряду Ca<Sr<Ba соответствует возрастанию прочности кристаллической решетки озонидов в группе щелочных и в группе щелочно-земельных металлов. Аналогично изменяется устойчивость пероксидов этих металлов.
Помимо озона, кислород образует малоустойчивые частицы О4 и  .
.
§ 2.3. Полиморфизм серы, селена и теллура.
Полиморфизм серы, селена и теллура связан с многообразием способов упаковки молекулярных цепей и циклов в кристаллах. Так, связи S- S легко изменяются и приспосабливаются к атомному окружению серы в соединениях. Межатомные расстояния
S- Sварьируютсяв очень широких пределах от 1.80 до 2.80 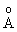 в зависимости от характера связей. Валентные углы S- S- Sпри этом могут изменяться от 90 до 180оС.
в зависимости от характера связей. Валентные углы S- S- Sпри этом могут изменяться от 90 до 180оС.
В зависимости от внешних условий цикло-октасера S8 существует в нескольких твердых модификациях:  -ромбическая [Термин "ромбическая" относится к внутреннему строению кристаллов. Выделяется наименьший элементарный объем в форме ортогонального параллелепипеда (а
-ромбическая [Термин "ромбическая" относится к внутреннему строению кристаллов. Выделяется наименьший элементарный объем в форме ортогонального параллелепипеда (а  b
b  c), с помощью которого путем операций симметрии (перенос, вращене и др.) можно построить весь бесконечный макрокристалл],
c), с помощью которого путем операций симметрии (перенос, вращене и др.) можно построить весь бесконечный макрокристалл],  -м оноклинная (Термин "моноклинная" расшифровывается аналогично, только наименьший элементарный объем выделяется в форме скошенного параллелепипеда (а
-м оноклинная (Термин "моноклинная" расшифровывается аналогично, только наименьший элементарный объем выделяется в форме скошенного параллелепипеда (а  b
b  c,
c,  =
=  = 90o,
= 90o, 
 90o)
90o)
Известны также аморфные фазы и фазы высокого давления.
 |
| Рис.2. Диаграмма состояния серы. |
На рис.2 изображена фазовая диаграмма серы в координатах давление (Р) - температура (Т). Линии ЕА, АС и СК представляют температурную зависимость давления насыщенного пара серы над твердой Sp, твердой Sм и жидкой Sж серой, соответственно. Линия АВ описывает зависимость температуры фазового перехода Sp  Sм от внешнего давления, а линии ВС и ВД - зависимость от внешнего давления (создаваемого, например, поршнем) температур плавления моноклинной и ромбической серы, соответственно. Область устойчивости ромбической Sp серы ограничена осью ординат и кривыми АВ, ВD и ЕА, а область существования моноклинной Sм модификации - кривыми ВС, AС и AВ. Область существования жидкой фазы расположена справа от кривых BС и BD и выше кривой CK. Область устойчивости парообразной серы лежит ниже кривых ЕА, АС и СК.
Sм от внешнего давления, а линии ВС и ВД - зависимость от внешнего давления (создаваемого, например, поршнем) температур плавления моноклинной и ромбической серы, соответственно. Область устойчивости ромбической Sp серы ограничена осью ординат и кривыми АВ, ВD и ЕА, а область существования моноклинной Sм модификации - кривыми ВС, AС и AВ. Область существования жидкой фазы расположена справа от кривых BС и BD и выше кривой CK. Область устойчивости парообразной серы лежит ниже кривых ЕА, АС и СК.
В областях существования конденсированных и газообразной форм серы устойчива только 1 фаза. Такому равновесию отвечают две степени свободы. Каждая кривая соответствует двухфазному равновесию, характеризующемуся одной степенью свободы.
В отличие от диаграммы состояния воды с одной тройной точкой на аналогичной диаграмме серы (рис.2) таких точек 3 (А, В и С). В каждой из них сосуществуют 3 фазы (например, в точке А - твердая ромбическая + твердая моноклинная + газообразная сера), и число степеней свободы равно О. Параметры таких тройных точек являются характеристическими константами вещества.
Термодинамически устойчивая в стандартных условиях  -ромбическая модификация серы состоит из циклических молекул S8. Молекула имеет форму короны, в которой длины
-ромбическая модификация серы состоит из циклических молекул S8. Молекула имеет форму короны, в которой длины
всех связей S- Sравны 2.06 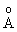 и валентный угол 108о (близкий к тетраэдрическому). При медленном нагревании
и валентный угол 108о (близкий к тетраэдрическому). При медленном нагревании  -сера обратимо переходит в
-сера обратимо переходит в  -моноклинную серу, кристаллы которой построены из таких же циклических коронообразных молекул S8, но в пространстве расположены по-другому. При закалке (быстром охлаждении) расплавленной серы от температур выше 300оС образуется метастабильная пластическая сера, образованная спиральными цепями с левым и правым винтовым вращением. Все без исключения модификации серы при комнатной температуре с течением времени превращаются в устойчивую ромбическую
-моноклинную серу, кристаллы которой построены из таких же циклических коронообразных молекул S8, но в пространстве расположены по-другому. При закалке (быстром охлаждении) расплавленной серы от температур выше 300оС образуется метастабильная пластическая сера, образованная спиральными цепями с левым и правым винтовым вращением. Все без исключения модификации серы при комнатной температуре с течением времени превращаются в устойчивую ромбическую  -серу.
-серу.
У селена также известны различные модификации. Три моноклинные модификации красного селена ( ,
,  и
и  ) образованы циклическими молекулами Se8 и различаются только способами их пространственной упаковки в кристаллах. Наиболее устойчивы у селена и теллура гексагональные модификации, образованные спиральными цепями атомов. В них каждый атом халькогена связан ковалентными связями с двумя своими ближайшими соседями по цепочке. Между параллельными цепочками действуют слабые межмолекулярные силы. Благодаря им Se и Те обладают сравнительно низкими температурами плавления.
) образованы циклическими молекулами Se8 и различаются только способами их пространственной упаковки в кристаллах. Наиболее устойчивы у селена и теллура гексагональные модификации, образованные спиральными цепями атомов. В них каждый атом халькогена связан ковалентными связями с двумя своими ближайшими соседями по цепочке. Между параллельными цепочками действуют слабые межмолекулярные силы. Благодаря им Se и Те обладают сравнительно низкими температурами плавления.
У металлического Ро известны 2 кристаллические модификации - низко- и высокотемпературная (кубическая и гексагональная), с температурой перехода 309 К.
§ 2.4. Поведение халькогенов при плавлении и испарении.
Свойства простых неметаллических веществ существенным образом зависят от строения их молекул и взаимодействия между ними. Рассмотрим в качестве примера изменение свойств серы при плавлении.
При плавлении кристаллов серы (Т=99.5оС) разрываются слабые межмолекулярные связи и освобождаются циклические молекулы S8, приобретающие при этом легкую подвижность. Вязкость расплава в этих условиях меньше вязкости воды. При 159.4оС все свойства жидкой серы изменяются скачкообразно (теплоемкость, плотность, сжимаемость, цвет, электропроводность, поверхностное натяжение и др.). Особенно резко меняется вязкость расплава, которая при нагревании до 195оС возрастает в 10 тысяч раз (расплав перестает выливаться из пробирки). Это связано с процессом двухступенчатой полимеризации, в результате которой образуются гомоцепи:
цикл - S8 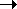 цепь - S8
цепь - S8
цепь - S8 + цикл -S8 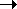 цепь - S16 и т.д.
цепь - S16 и т.д.
В результате полимеризации, протекающей по бирадикальному механизму, при ~ 180оС собираются цепи длиной более 200 тысяч атомов серы. При дальнейшем нагревании вязкость расплава понижается из-за начинающейся деполимеризации. Цепи постепенно укорачиваются до ~ 1000 атомов при 400оС и до ~ 100 атомов при 600оС. Выше 445оC давление насыщенного пара над жидкой серой превышает 105 Па (1атм). В паре присутствуют все молекулы Sn (2  n
n  10), включая молекулы с нечетным числом атомов.
10), включая молекулы с нечетным числом атомов.
В структуре твердого и жидкого селена (Г.Г.Девятых, М.Ф.Чурбанов "Высокочистые халькогены", Горький,1974, с.243) содержатся цепи и циклы Se8. В отличие от серы селен не имеет температурной области, в которой его расплав состоял бы только из циклических молекул. При нагревании до 620оС степень полимеризации и вязкость возрастают, а в интервале 620-920оС уменьшаются. В теллуре в соответствии с увеличением доли металлической связи по сравнению с серой и селеном циклические структуры не присутствуют ни в твердой, ни в жидкой фазах. В паре над селеном и теллуром присутствуют молекулы Sen (2  n
n  9) и Теn (2
9) и Теn (2  n
n  7).
7).
§ 3. Химические свойства халькогенов.
Сера - химически активное вещество, особенно при повышенных температурах, облегчающих разрыв связей S- S. Она непосредственно соединяется с многими простыми веществами, за исключением инертных газов, N, Te, I, Pt, Au. Однако соединения серы с азотом, теллуром, иодом, платиной и золотом синтезированы косвенными методами.
Сера медленно реагирует с Н2 при 120оС и значительно быстрее при температуре выше 200оС, образуя Н2S, сгорает во фторе с образованием SF6. Реакция серы с хлором сильно ускоряется при нагревании: ее продуктами являются S2Cl2 и SCl2. Во влажном
воздухе сера медленно окисляется, на воздухе при 250-260оС сгорает до SО2.
Реакционная способность серы определяется особенностью строения и прочностью связи S- S в молекулах Sn. Циклические молекулы S8 в твердой сере менее активны, чем бирадикальные цепочки S8, образующиеся в расплаве (см. § 2.4). Получаемая фотолизом паров атомарная сера отличается очень высокой реакционной способностью.
Как и у молекулярного кислорода (см. § 2.2), у молекулярной серы возможны два электронных состояния: триплетное и синглетное с разными химическими активностями.
Основное триплетное состояние с двумя неспаренными электронами лежит на 110.52 кДж/моль ниже возбужденного синглетного состояния без неспаренных электронов. Например, парафиновые углеводороды инертны к триплетной сере, но в присутствии синглетной серы образуют меркаптаны: RH + S 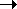 RSH.
RSH.
Se, Teи Po соединяются непосредственно с большинством простых веществ, хотя и труднее, чем О и S. Среди их соединений наиболее устойчивы селениды, теллуриды и полониды металлов, но их устойчивость ниже, чем у аналогичных оксидов и сульфидов.
С сильно электроотрицательными элементами (F, O и Cl) халькогены проявляют положительные степени окисления +2, +4 и +6.
Как и элементы VII группы, халькогены диспропорционируют в воде:
2/n Эn + Н2О  Н2Э + Н2ЭО3.
Н2Э + Н2ЭО3.
Равновесие существенно смещается в сторону продуктов реакции при кипячении и в присутствии щелочей:
3Э + 6NaOH 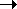 2Na2Э + Na2ЭО3 + 3Н2О.
2Na2Э + Na2ЭО3 + 3Н2О.
§ 4. Халькогены в природе. Получение простых веществ.
В природе халькогены сосредоточены в рудных месторождениях, где они связаны преимущественно с металлами. Значительная часть серы находится либо в самородном состоянии (вулканическая сера), либо в форме сульфидов и сульфатов (CuFeS2 - халькопирит, ZnS - сфалерит, FeAsS - арсенит, CaSO4. 2H2O - гипс, Na2SO4. 10Н2О - мирабилит). Большие месторождения самородной серы находятся в США, в России они расположены в районе Самарской Луки на Волге. Огромное количество серы содержится в нефти и в нефтяных газах, откуда их извлекают в процессе технологической очистки. Присутствие соединений серы в нефти создает экологические и технологические проблемы. Например, в газовых месторождениях около Астрахани содержание Н2S достигает десятков процентов. Без глубокой очистки такие газы нельзя сжигать из-за химического отравления природы сернистым газом и нельзя перекачивать из-за сероводородной коррозии трубопроводов, скорость которой достигает нескольких мм в год.
Из подземных месторождений серу извлекают, расплавляя ее перегретой водой (165оС) и выдавливая из-под земли сжатым воздухом. Расплав перекачивают в емкости или распыляют в воду для получения тонкого порошка. При этом получают продукт чистотой 99.5-99.9% без примесей Se, Te и As.
Серу из сероводорода получают процессом Клауса. Около 1/3 объема извлеченного из нефти H2S сжигают до SO2, H2O и паров серы:
 (Аналогичный процесс происходит при попадании воды в кратеры вулканов, а также в глубине Земли в результате деятельности микроорганизмов)
(Аналогичный процесс происходит при попадании воды в кратеры вулканов, а также в глубине Земли в результате деятельности микроорганизмов)

Затем остальную часть H2S в присутствии оксидных катализаторов (Fe2O3, AlO3) подвергают взаимодействию с SO2:

Основным источником Se и Te служит шлам после электролитической очистки меди, который содержит значительные количества Ag, Au и платиновых металлов. Шлам подвергают окислительному обжигу с содой:

При отсутствии соды происходит улетучивание SeO2:
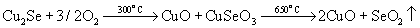

Разделение Se и Te достигается обработкой серной кислотой:
Na2SeO3 + Na2TeO3 + H2SO4 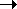
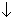 TeO2. nH2O + H2SеO3 + 2Na2SO4.
TeO2. nH2O + H2SеO3 + 2Na2SO4.
Теллур осаждается в виде гидратированного диоксида, H2SeO3 остается в растворе. Из этого раствора действием SO2 осаждают красный Se чистотой 99.5%:
H2SeO3 + 2SO2 + H2O 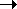
 Se + 2H2SO4.
Se + 2H2SO4.
Гидратированный ТеО2 растворяют в щелочи и подвергают электролитическому восстановлению до Те:

Металлический Ро получают термическим разложением в вакууме сульфида полония (275оС) или диоксида РоО2 (~500оС) с последующей возгонкой металла. Также можно его получать восстановлением РоО2 водородом (200оС) или РоBr2 сухим аммиаком:
3PoBr2 + 2NH3  3Po + N2 + 6HBr
3Po + N2 + 6HBr
§ 5. Строение молекулы Н2Э.
 | 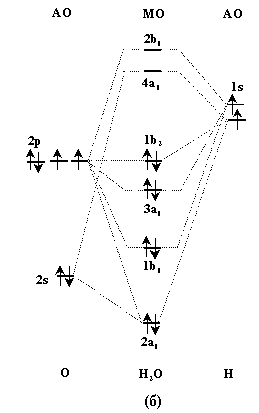 |
Рис.3. Схема расположения координатных осей (а) и энергетическая диаграмма орбиталей молекулы Н2О (б).
Строение молекул гидридов халькогенов Н2Э можно проанализировать с помощью метода молекулярных орбиталей (МО). В качестве примера рассмотрим схему молекулярных орбиталей молекулы воды (рис.3)
Для построения (Подробнее см. Г.Грей "Электроны и химическая связь",М., изд-во "Мир", 1967, с.155-62 и G.L.Miessier, D.A.Tarr, "Inorganic Chemistry", Prantice Hall Int.Inc., 1991, p.153-57) схемы МО молекулы Н2О совместим начало координат с атомом кислорода, а атомы водорода расположим в плоскости xz (рис.3). Перекрывание 2s- и 2p-АО кислорода с 1s-АО водорода показано на рис.4. В формировании МО принимают участие АО водорода и кислорода, обладающие одинаковой симметрией и близкими энергиями. Однако вклад АО в образование МО разный, что отражается в разных величинах коэффициентов в соответствующих линейных комбинациях АО. Взаимодействие (перекрывание) 1s-АО водорода, 2s- и 2рz-АО кислорода приводит к образованию 2a1-связывающей и 4a1-разрыхляющей МО.

Рис.4. Перекрывание 2s- (а), 2p x - (б) и 2p я - (в)орбиталей атома кислорода с 1s-орбиталями двух атомов водорода молекулы воды.
c1  (2so) + c2
(2so) + c2  (2pz,o) + c3
(2pz,o) + c3  (1sн) =
(1sн) =  МО(2a1)
МО(2a1)
c4  (2so) + с5
(2so) + с5  (1sн) -с6
(1sн) -с6  (2pz,o) =
(2pz,o) =  МО(4a1).
МО(4a1).
При этом в энергию связывающей МО увеличенный вклад вносит АО с более низкой энергией, а в энергию разрыхляющей МО - атомная орбиталь с более высокой энергией. С учетом этого с1>>c2, а с5>c4 и с6. При перекрывании 2рх-АО кислорода и 1s-АО водорода образуются 1b1-связывающая и 2 b1-разрыхляющая МО:
с7  (2рх,о) + с8
(2рх,о) + с8  (1sн) =
(1sн) =  МО(1b1) (с7>>c8)
МО(1b1) (с7>>c8)
с9  (2рх,о) - с10
(2рх,о) - с10  (1sн) =
(1sн) =  МО(2b1) (с9>>c10).
МО(2b1) (с9>>c10).
2рz-АО кислорода и 1s-АО водорода образуют также 3a1 - практически несвязывающую МО.
с11  (2pz) + с12
(2pz) + с12  (1sн) =
(1sн) =  МО(3a1),
МО(3a1),
так как с11>>c12 (рис.4в) из-за слабого перекрывания атомных орбиталей.  -орбиталь кислорода расположена перпендикулярно плоскости xz, по условиям симметрии не перекрывается с 1s-орбиталями атома водорода и поэтому дает 1b2 несвязывающую орбиталь (рис.3б).
-орбиталь кислорода расположена перпендикулярно плоскости xz, по условиям симметрии не перекрывается с 1s-орбиталями атома водорода и поэтому дает 1b2 несвязывающую орбиталь (рис.3б).
Взаимодействие 4-х атомных орбиталей кислорода (2s-, 2рх-,  , 2pz) и двух 1s-орбиталей атомов водорода приводит к образованию шести молекулярных орбиталей: двух связывающих (2а1 и 1b1), двух несвязывающих (3а1 и 1b2) и двух разрыхляющих (4а1 и 2b1). 8 электронов атомов водорода и кислорода размещаются попарно на двух связывающих и двух несвязывающих орбиталях. Из схемы, изображенной на рис.3б, можно сделать следующие выводы.
, 2pz) и двух 1s-орбиталей атомов водорода приводит к образованию шести молекулярных орбиталей: двух связывающих (2а1 и 1b1), двух несвязывающих (3а1 и 1b2) и двух разрыхляющих (4а1 и 2b1). 8 электронов атомов водорода и кислорода размещаются попарно на двух связывающих и двух несвязывающих орбиталях. Из схемы, изображенной на рис.3б, можно сделать следующие выводы.
- Молекулы Н2О, как и молекулы других гидридов халькогенов, диамагнитны.
- Электроны на связывающих 2а1 и 1b1 орбиталях обеспечивают связи О- Н, а на несвязывающих (3а1 и 1b2) орбиталях соответствуют свободным электронным парам в молекуле Н2О, как это описывается в рамках метода валентных связей.
- Принципиальным отличием ММО от МВС является разная энергия ионизации занятых молекулярных орбиталей, составляющая (в эВ) 27.3 (2а1), 16.2 (1b1), 14.5 (3а1) и 12.6 (1b2), соответственно.
- ММО (в отличие от МВС) позволяет оценить разницу в энергиях молекулярных орбиталей: ev (E). В частности, существенным является различие в энергии двух несвязывающих орбиталей 3а1 и 1b2. Это связано с различной природой орбиталей - 1b2 локализована на атоме кислорода, тогда как 3а1 образована с участием АО водорода и кислорода и не является локализованной. Локализация электронов на 1b2 МО приводит к тому, что отрицательный заряд в молекуле Н2О сосредоточен вблизи атома кислорода, а положительный - вблизи атомов водорода. Таким образом, молекула Н2О оказывается полярной (дипольный момент
 = l. q= 1.84D, табл.5). Это соответствует и простым соображениям электроотрицательности: связывающие электроны смещаются к более электроотрицательному атому.
= l. q= 1.84D, табл.5). Это соответствует и простым соображениям электроотрицательности: связывающие электроны смещаются к более электроотрицательному атому.
Так как у молекулы Н2О в образовании связей принимают в основном участие 2р-орбитали кислорода и 1s-орбитали водорода, то можно ожидать, что угол Н- О- Н должен быть близким к 90о. Однако из эксперимента следует, что этот угол равен 104.5о (табл.5). Причина такого различия заключается в том, что этот угол соответствует минимуму энергии. Согласно квантово-механическим расчетам, энергия молекулы зависит не только от энергии молекулярных орбиталей и числа электронов на них, но и от валентного угла Н- О- Н. В приближении МВС увеличение угла Н- О- Н от 90о (характерного для взаимодействия р-орбиталей) до 104.5о связано с взаимным отталкиванием положительно заряженных атомов водорода.
При переходе от Н2О к Н2S, H2Se и H2Te диаграммы МО изменяются, что обусловлено увеличением энергий исходных АО халькогенов: Е3s = -20.7 эВ; Е3р = -12.0 эВ; Е4s = 20.8 эВ; Е4р = 11.9 эВ. Поэтому растет участие ns-атомных орбиталей халькогена в образовании молекулярных орбиталей. При этом несвязывающий характер орбиталей nb2 сохраняется, а связывающий характер орбиталей 2а1 усиливается. В целом, по мере увеличения энергии атомных орбиталей ns- и nр- уменьшается разность сумм энергий молекулярных и атомных орбиталей, которые характеризуют прочность молекул Н2Э. Вклады nр-АО атомов халькогенов в энергию МО уменьшаются, и соответственно понижается локализация электронов на атомах халькогенов и полярность молекул. Вероятно, благодаря этому уменьшаются валентные углы Н- Э- Н в молекулах. Именно так, с точки зрения теории МО ЛКАО, объясняется понижение устойчивости молекул H2S, H2Sе, H2Te по сравнению с молекулой Н2О.
§ 6. Физические свойства гидридов Н2Э.
Некоторые физические свойства водородных соединений халькогенов представлены в табл.5.
Таблица 5.Физические свойства гидридов ЭН2 элементов VI группы.
| Гидрид Свойство | H2O | H2S | H2Se | H2Te |
Длина связей Э-Н,  | 0.957 | 1.336 | 1.46 | 1.69 |
| Энергия связи Э-Н, кДж/моль | 463 | 347 | 276 | 238 |
| Валентный угол Н-Э-Н, о | 104.5 | 92.1 | 91 | 90 |
| Дипольный момент, D | 1.844 | 0.92 | 0.24 | |
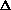 fGo, кДж/моль fGo, кДж/моль | -237.24 (ж) | -33.8 (г) | 19.7 (г) | 85,07 (г) |
| Т.пл., оС | 0.0 | -85.6 | -65.7 | -51 |
| Т.кип., оС | 100.0 | -60.3 | -41.4 | -2 |
| К дисс. К1 (до НЭ-) К2 (до Э2- ) | 1.8. 10-16 * ) - | 1.05. 10-7 1.23. 10-13 | 1.55. 10-4 1.00. 10-11 | 2.29. 10-3 6.76. 10-13 |
*) Константа автопротолиза.
По мере увеличения размера атомов халькогенов длина связи Н-Э увеличивается, а ее энергия, а, следовательно, энергия Гиббса образования (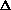 fGo) и термодинамическая стабильность Н2Э, уменьшаются. Понижение устойчивости молекул H2S, H2Se, H2Te по сравнению с Н2О объясняется ростом размеров np-орбиталей и уменьшением их перекрывания с 1s-орбиталями атомов водорода.
fGo) и термодинамическая стабильность Н2Э, уменьшаются. Понижение устойчивости молекул H2S, H2Se, H2Te по сравнению с Н2О объясняется ростом размеров np-орбиталей и уменьшением их перекрывания с 1s-орбиталями атомов водорода.
Изменение угла Н- Э- Н в ряду Н2О- H2S- H2Se- H2Te с точки зрения МВС можно объяснить тем, что с ростом размеров атомов халькогенов отталкивание между атомами водорода, а значит, и величина угла Н- Э- Н уменьшаются.
В стандартных условиях гидриды Н2Э являются газами. С ростом массы и размеров молекул Н2Э усиливается межмолекулярное взаимодействие и, как следствие, повышаются температуры и энтальпии плавления и кипения (табл.5). Аномально высокие температуры фазовых переходов у воды объясняются усилением межмолекулярного взаимодействия за счет образования водородных связей.
§ 7. Химические свойства Н2Э.
Газообразные гидриды Н2Эрастворимы в воде примерно одинаково: насыщенный раствор Н2Sпри атмосферном давлении и 25оС имеет концентрацию 0.1 моль/л. В водных растворах Н2Эведут себя как слабые двухосновные кислоты. Сила кислот возрастает от серы к теллуру благодаря понижению энергии связи Э- Н и облегчению протолитического взаимодействия с водой (табл.5):
Н2Э + Н2О  Н3О+ + HЭ-.
Н3О+ + HЭ-.
Средние соли этих кислот, то есть сульфиды, селениды и теллуриды, встречаются в природе как минералы и руды металлов и служат источником их получения. На различной растворимости сульфидов в растворах с регулируемой кислотностью основаны методы разделения и аналитического определения металлов.
Рассмотрим в первом приближении процесс осаждения труднорастворимых сульфидов двухвалентных металлов из растворов их солей при действии газообразного H2S.
В насыщенном водном растворе H2S концентрация протонов определяется растворимостью сероводорода и его константами диссоциации:


Отсюда следует, что [H+]2[S2- ] = 1.3. 10- 20. [H2S] = 1.3. 10- 21. Поскольку К2 меньше К1 на 6 порядков, то основной вклад в концентрацию [H+] в растворе H2S вносит К1. Таким образом, [H+]=[HS- ]= 
 10-4.
10-4.
При подстановке этого значения в соотношение [H+]2[S2- ] = 1.3. 10- 21 получаем, что концентрация ионов S2- в насыщенном растворе H2S равна ~1.3. 10- 13. Учитывая эту величину, оцените: 1) Будет ли осаждаться CuS при действии H2S на раствор 0.01 М CuSO4 (ПР = 1.4. 10-36)? 2) Будет ли осаждаться MnS при действии H2S на раствор 0.01 М MnSO4 (ПР =1.1. 10- 13)? (1. Ионное произведение, [Cu2+][S2- ] = 10-2. 1.3. 10-13 =1.3. 10-15, превышает ПР, и осадок выпадает. 2) Ионное произведение, [Mn2+][S2-]= 10-2. 1.3. 10-13 = =1.3. 10- 15, не достигает ПР, и осадок не образуется.)
Халькогеноводороды сгорают на воздухе с образованием диоксидов: Н2Э + 3/2 О2 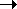 ЭО2 + Н2О. В кислых растворах Н2Э ведут себя как мягкие восстановители. Восстановительные свойства Н2Эусиливаются при переходе от Н2Ок Н2Ро, о чем свидетельствуют значения стандартных окислительно-восстановительных потенциалов (табл.6). Кислород, галогены, кислоты-окислители, перманганат-ион быстро и количественно взаимодействуют с водными растворами халькогеноводородов, выделяя халькоген в форме простых веществ Э. Сероводород в зависимости от условий проведения реакции может окисляться до серы, SO2, тиосульфата, политионатов, H2SO4. Для сероводорода характерна реакция с диоксидом серы: SO2(г) + 2H2S(г)
ЭО2 + Н2О. В кислых растворах Н2Э ведут себя как мягкие восстановители. Восстановительные свойства Н2Эусиливаются при переходе от Н2Ок Н2Ро, о чем свидетельствуют значения стандартных окислительно-восстановительных потенциалов (табл.6). Кислород, галогены, кислоты-окислители, перманганат-ион быстро и количественно взаимодействуют с водными растворами халькогеноводородов, выделяя халькоген в форме простых веществ Э. Сероводород в зависимости от условий проведения реакции может окисляться до серы, SO2, тиосульфата, политионатов, H2SO4. Для сероводорода характерна реакция с диоксидом серы: SO2(г) + 2H2S(г) 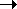 3S(тв.) + +2Н2О(г). При проведении этой реакции в водных растворах (жидкость Вакенродера) в продуктах найдены сера, тиосульфат-ион, политионовые кислоты и другие частицы.
3S(тв.) + +2Н2О(г). При проведении этой реакции в водных растворах (жидкость Вакенродера) в продуктах найдены сера, тиосульфат-ион, политионовые кислоты и другие частицы.
 2020-06-29
2020-06-29 958
958











