
| H2SeO4 | H2TeO4 . 2H2O=H6TeO6 | |
pK1: Н2ЭО4 = Н++НЭO4-
pK2:  
| - 3.0 1.92 | - 1.0 2.0 | 7.7 - |
Ео, В; рН = 0:

| 0.16 | ||

| 1.15 | ||

| 1.04 | ||
Ео, В; рН = 14:


| -0.93 | 0.03 | +0.40 |
Серная и селеновая кислоты являются сильными двухосновными кислотами и близки по структуре и свойствам между собой. Их константы диссоциации в водных растворах одного порядка (К2 для  и
и  равны 1.2. 10-2 и 2.19. 10-2, соответственно), селенаты изоморфны с сульфатами), образуя, например, квасцы состава МAl(SeO4)3 . 12H2O, гдеМ - тяжелый щелочной металл.
равны 1.2. 10-2 и 2.19. 10-2, соответственно), селенаты изоморфны с сульфатами), образуя, например, квасцы состава МAl(SeO4)3 . 12H2O, гдеМ - тяжелый щелочной металл.
Строение ортотеллуровой кислоты H6TeO6 отличается от строения серной и селеновой кислот (сравнить с кислородными кислотами галогенов HClO4, HBrO4 и H5IO6). Кристаллическая структура твердой H6TeO6 (т.пл. 136оС) построена из молекул правильной октаэдрической формы, которые сохраняют свою форму и в растворах. Теллураты не изоморфны с сульфатами и селенатами. Ортотеллуровая кислота щелочью титруется как одноосновная с образованием солей MITeO(OH)5, она слабее угольной кислоты. Получены продукты полного (Ag6TeO6 , Na6TeO6) и частичного (NaH5TeO6, Na2H4TeO6, Na4H2TeO6)замещения протонов ионами металлов.
Селеновая кислота более сильный окислитель, чем Н2SO4 и Н6ТеО6 (табл.9). Она растворяет без нагревания Cu и даже Au: 2Au + 6H2SеO4 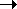 Au2(SeO4)3 + 3 H2SeO3 + 2H2O, окисляет ионы галогенидов, кроме фторида, до свободных галогенов, под ее действием воспламеняется клетчатка. Ортотеллуровая кислота также более сильный окислитель, чем серная кислота. Наиболее частым продуктом восстановления H2SeO4и H6TeO6 являются простые вещества.
Au2(SeO4)3 + 3 H2SeO3 + 2H2O, окисляет ионы галогенидов, кроме фторида, до свободных галогенов, под ее действием воспламеняется клетчатка. Ортотеллуровая кислота также более сильный окислитель, чем серная кислота. Наиболее частым продуктом восстановления H2SeO4и H6TeO6 являются простые вещества.
Серная кислота обладает сильными окислительными свойствами только в концентрированном виде и при нагревании:
Cu + 2 H2SO4  CuSO4 + SO2 + 2H2O.
CuSO4 + SO2 + 2H2O.
Продуктами ее восстановления в зависимости от условий проведения реакций могут быть SO2 (при избытке H2SO4), H2S, S, 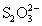 , политионаты (при недостатке H2SO4).
, политионаты (при недостатке H2SO4).
В ряду 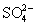 -
-  - H5Te
- H5Te  наблюдается аномалия в последовательности изменения термодинамической cтабильности и окислительной способности: селеновая кислота и ее соли термодинамически оказываются менее стабильными и более сильными окислителями, чем соответствующие кислоты и соли S(VI) и Te(VI). Наклон линии, соединяющей вольт-эквивалентные пары
наблюдается аномалия в последовательности изменения термодинамической cтабильности и окислительной способности: селеновая кислота и ее соли термодинамически оказываются менее стабильными и более сильными окислителями, чем соответствующие кислоты и соли S(VI) и Te(VI). Наклон линии, соединяющей вольт-эквивалентные пары  , больше, чем наклон соответствующих линий для H6TeO6- H2TeO3 и
, больше, чем наклон соответствующих линий для H6TeO6- H2TeO3 и 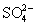 - H2SO3 (рис.7). Больший потенциал пары
- H2SO3 (рис.7). Больший потенциал пары  /
/ 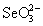 по сравнению с парами H6TeO6 / H2TeO3 и
по сравнению с парами H6TeO6 / H2TeO3 и  / H2SO3 приводит к тому, что H2SеO4, например, выделяет хлор из концентрированной HCl: H2SеO4 + 2HCl = =Cl2 + H2SeO3 + H2O. Аналогичные немонотонные изменения свойств элементов и их соединений, в частности, оксокислот, наблюдаются и для других элементов 4-го периода, например,
/ H2SO3 приводит к тому, что H2SеO4, например, выделяет хлор из концентрированной HCl: H2SеO4 + 2HCl = =Cl2 + H2SeO3 + H2O. Аналогичные немонотонные изменения свойств элементов и их соединений, в частности, оксокислот, наблюдаются и для других элементов 4-го периода, например,  , и иногда называются вторичной периодичностью. Можно полагать, что рассматриваемые аномалии связаны с понижением прочности связи Se- O по сравнению со связью S- O. В свою очередь, это вызвано увеличением размера и энергий 4s- и 4p-орбиталей атома селена по сравнению с размером и энергиями 2s- и 2p-орбиталей кислорода, и следовательно, с уменьшением взаимодействия (перекрывания) 4s-,4p - орбиталей селена и 2s, 2p-орбиталей кислорода (энергии 2s-, 2p-, 3s-, 3p-, 4s- и 4p-атомных орбиталей составляют - 32.4, - 15.9, - 20.7, - 12.0, - 17.6 и - 9.1эВ, соответственно). Повышение стабильности и уменьшение окислительной способности оксосоединений при переходе от Se(VI) к Te(VI ) обусловлено особенностями строения и увеличением прочности связи Te- O в октаэдрических ионах TeO6 по сравнению со связью Se- O в тетраэдрах
, и иногда называются вторичной периодичностью. Можно полагать, что рассматриваемые аномалии связаны с понижением прочности связи Se- O по сравнению со связью S- O. В свою очередь, это вызвано увеличением размера и энергий 4s- и 4p-орбиталей атома селена по сравнению с размером и энергиями 2s- и 2p-орбиталей кислорода, и следовательно, с уменьшением взаимодействия (перекрывания) 4s-,4p - орбиталей селена и 2s, 2p-орбиталей кислорода (энергии 2s-, 2p-, 3s-, 3p-, 4s- и 4p-атомных орбиталей составляют - 32.4, - 15.9, - 20.7, - 12.0, - 17.6 и - 9.1эВ, соответственно). Повышение стабильности и уменьшение окислительной способности оксосоединений при переходе от Se(VI) к Te(VI ) обусловлено особенностями строения и увеличением прочности связи Te- O в октаэдрических ионах TeO6 по сравнению со связью Se- O в тетраэдрах  . Атом теллура по сравнению в атомом селена имеет бу льший радиус, для него характерно координационное число 6. Увеличение числа координируемых атомов кислорода приводит к росту числа электронов на связывающих молекулярных орбиталях и, соответственно, к повышению прочности связи.
. Атом теллура по сравнению в атомом селена имеет бу льший радиус, для него характерно координационное число 6. Увеличение числа координируемых атомов кислорода приводит к росту числа электронов на связывающих молекулярных орбиталях и, соответственно, к повышению прочности связи.
 2020-06-29
2020-06-29 117
117








