Оксокислоты халькогенов (VI) H2SO4, H2SeO4и H6TeO6 синтезируют окислением их диоксидов (или соответствующих им кислот):

H2SeO3 + Н2О2  H2SeO4 + Н2О
H2SeO4 + Н2О
5TeO2 + 2KMnO4 + 6HNO3 + 12 Н2О  5H6TeO6 + 2KNO3 + 2Mn(NO3)2,
5H6TeO6 + 2KNO3 + 2Mn(NO3)2,
а также окислением простых веществ сильными окислителями:
5Te + 6HClO3 + 12H2O  5H6TeO6 + 3Cl2,
5H6TeO6 + 3Cl2,
или обменными реакциями:
BaTeO4 + H2SO4 + 2H2O  H6TeO6 + BaSO4.
H6TeO6 + BaSO4.
В молекуле H2SO4 сера тетраэдрически окружена двумя гидроксильными (ОН) группами и двумя атомами кислорода. Длины связей (расстояние S- ОН равно 1.54 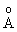 , а расстояние S- О равно 1.43
, а расстояние S- О равно 1.43  ) в молекуле H2SO4 таковы, что связи S- О можно считать двойными, а связи S- ОН - одинарными. Бесцветные, похожие на лед кристаллы H2SO4 имеют слоистую структуру, в которой каждая молекула H2SO4 соединена с четырьмя соседними молекулами прочными водородными связями, образуя единый пространственный каркас. При температуре 10.48оС H2SO4 плавится с образованием тяжелой (d = 1.838 г/мл при 15оС) маслянистой жидкости, кипящей при 280оС. У жидкой H2SO4 структура почти такая же, как у твердой, только целостность пространственного каркаса нарушена, и его можно представить как совокупность микрокристалликов, постоянно меняющих свою форму. H2SO4 смешивается с водой в любых соотношениях, что сопровождается образованием гидратов H2SO4. n H2O(рис.8). Теплота гидратации настолько велика, что смесь может даже закипеть.
) в молекуле H2SO4 таковы, что связи S- О можно считать двойными, а связи S- ОН - одинарными. Бесцветные, похожие на лед кристаллы H2SO4 имеют слоистую структуру, в которой каждая молекула H2SO4 соединена с четырьмя соседними молекулами прочными водородными связями, образуя единый пространственный каркас. При температуре 10.48оС H2SO4 плавится с образованием тяжелой (d = 1.838 г/мл при 15оС) маслянистой жидкости, кипящей при 280оС. У жидкой H2SO4 структура почти такая же, как у твердой, только целостность пространственного каркаса нарушена, и его можно представить как совокупность микрокристалликов, постоянно меняющих свою форму. H2SO4 смешивается с водой в любых соотношениях, что сопровождается образованием гидратов H2SO4. n H2O(рис.8). Теплота гидратации настолько велика, что смесь может даже закипеть.

Рис.8. Т-х диаграмма системы H2O-H2SO4.
Жидкая H2SO4 удивительно похожа на воду со всеми структурными особенностями и аномалиями. Здесь та же система сильных водородных связей, что и в воде, почти такой же прочный пространственный каркас, такие же аномально высокие вязкость, поверхностное натяжение, температуры плавления и кипения. Диэлектрическая проницаемость H2SO4 велика (
 100). По этой причине собственная диссоциация (автоионизация) у серной кислоты заметно больше, чем у воды: 2H2SO4
100). По этой причине собственная диссоциация (автоионизация) у серной кислоты заметно больше, чем у воды: 2H2SO4  H3SO4+ + HSO4- , К = 2.7 . 10-4.
H3SO4+ + HSO4- , К = 2.7 . 10-4.
Из-за высокой полярности связь Н- О легко разрывается, причем отщепление протона требует меньших энергетических затрат, чем у воды. По этой причине кислотные свойства у H2SO4 выражены сильно и при растворении в безводной H2SO4 большинство соединений, традиционно считавшихся кислотами (CH3COOH, HNO3, H3PO4 и др.), ведут себя как основания, вступая в реакции нейтрализации и повышая концентрацию анионов  :
:
H2O + H2SO4 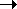 H3O+ +
H3O+ +  ,
,
основание
CH3COOH + H2SO4 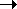 CH3C(OH)2+ +
CH3C(OH)2+ + 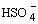 ,
,
основание
HNO3 + 2 H2SO4 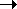 NO2+ + H3O+ +2
NO2+ + H3O+ +2 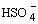 ,
,
основание
Лишь несколько соединений (HClO4, FSO3H) при растворении в H2SO4 ведут себя как слабые кислоты, то есть протон у них отщепляется легче, чем у H2SO4, что приводит к росту концентрации сольватированного протона 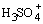 , например,
, например,
HSO3F + H2SO4 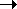
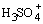 + SO3F-.
+ SO3F-.
кислота
Некоторые свойства оксокислот халькогенов (VI) приведены в табл.9.
 2020-06-29
2020-06-29 148
148








