Пептидная цепь может укладываться в виде спирали.
В одном витке спирали умещаются 3,6 аминокислотных остатка, т. е. каждая аминокислота связывается с 5 по счету в первичной последова- тельности. Например, в последовательности Гли–Ала–Фен–Глу–Сер–Ала, остаток глицина образует водородную связь с остатком серина.
Кроме водородных связей могут быть и другие виды взаимодействий, приводящие к стабилизации цепи в пространстве: ионные взаимодействия между заряженными группами СОО– и NН3 – ковалентные связи S–S за счет окисления групп SH — остатков цистеина.
Другим видом вторичной структуры полипептидов и белков является β-структура, называемая также складчатым листом, или складчатым слоем. В складчатые листы укладываются вытянутые полипептидные цепи, связываемые множеством водородных связей между пептидными группами этих цепей.Во многих белках одновременно содержатся α-спиральные и β-складчатые структуры.
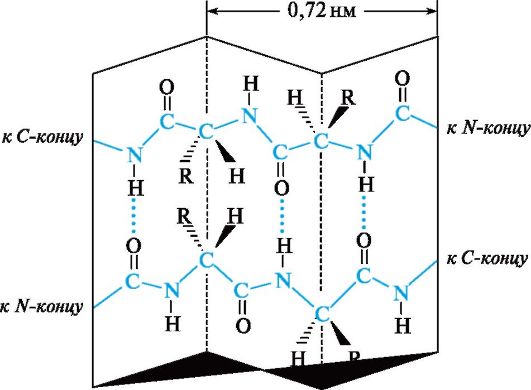
Вторичная структура полипептидной цепи в виде складчатого листа (β-структура)
 2020-07-12
2020-07-12 178
178








