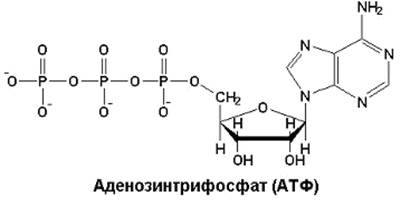
В энергетическом обеспечении клетки важнейшую роль играет адениловая система, которая включает АМФ, АДФ, АТФ, Н4Р2О7 (пирофосфат), Н3РО4 (неорганический фосфат) и цАМФ (циклический АМФ). Вопрос об адениловой системе сводится к процессам распада, синтеза АТФ и ее значению для процессов жизнедеятельности клетки. Главным компонентом адениловой системы клетки является АТФ. Это макроэргическое соединение. Как известно, к макроэргическим относятся соединения, при гидролизе которых высвобождается не менее, чем 5 ккал/моль. В ряду макроэргов клетки АТФ отводится главная роль.
Суммарная концентрация адениловых нуклеотидов в клетке постоянна, но относительные концентрации адениловых нуклеотидов могут изменяться вследствие их взаимопревращений. Во многих клетках концентрации АТФ, АДФ и АМФ относятся примерно как 100: 10: 1. Отсюда следует, что небольшие изменения концентрации АТФ могут приводить к значительным изменениям концентрации других нуклеотидов. Это имеет существенное значение, поскольку адениловые нуклеотиды способны выступать в роли аллостерических эффекторов и изменять активность ряда аллостерических ферментов энергетического обмена.
Для оценки влияния системы адениловых нуклеотидов на метаболические процессы пользуются величиной энергетического заряда клетки:
- если весь фонд адениловых нуклеотидов представлен только АТФ (максимум высокоэнергетических связей), то энергетический заряд равен единице. Если в клетке имеется только АМФ (высокоэнергетических связей нет), то энергетический заряд равен нулю. В большинстве клеток энергетический заряд равен 0,8-0,9, т.е. адениловая система клетки почти насыщена энергией. При уменьшении энергетического заряда скорость потребления кислорода и реакций общего пути катаболизма возрастает.
Другие макроэргические соединения:
Фосфоенолпируват (-61,9 кДж/моль)
1,3-дифосфоглицерат (-49,4 кДж/моль)
Карбамоилфосфат (-51,5 кДж/моль)
Ацетилфосфат (-43,15 кДж/моль)
Креатинфосфат (-37,7 кДж/моль)
Сукцинил-КоА (-33,5 кДж/моль)
Ацетил-КоА (-31,4 кДж/моль)
АТФ (до АМФ) (-31,8 кДж/моль)
АТФ (до АДФ) (-31,0 кДж/моль)
АДФ (до АМФ) (-28,3 кДж/моль)
Глюкозо-1-фосфат (-20,7 кДж/моль)
Фруктозо-6-фосфат (-15,8 кДж/моль)
Глюкозо-6-фосфат (-13,8 кДж/моль)
Глицерофосфат (10,0 кДж/моль)
Механизмы синтеза АТФ
Наиболее эффективный способ синтеза АТФ использует энергию градиента электрохимического потенциала для образования АТФ из АДФ (ADP) и неорганического фосфата. Энергия для создания такого градиента возникает в результате окислительно-восстановительного процесса. Этот механизм называют окислительным фосфорилированием. Транспортирующая Н+ АТФ-синтаза использует для синтеза АТФ энергию градиента потенциала. У эукариот окислительное фосфорилирование происходит только в присутствии кислорода (то есть в аэробных условиях).
Второй, эволюционно более ранний способ синтеза АТФ осуществляется в анаэробных условиях. Он основан на переносе фосфатных остатков на АДФ через метаболит с высоким потенциалом переноса фосфатных групп. В качестве примера здесь представлено образование АТФ из креатин-фосфата — соединения, которое служит в мышцах энергетическим ресурсом (см. Источники энергии). Формально перенос фосфатной группы с креатинфосфата на АДФ является суммарной реакцией гидролиза креатинфосфата и синтеза АТФ
---
3. Окислительно-восстановительные процессы в тканях.+ Оксидоредуктазы, коферменты оксидоредуктаз. + Роль кислорода в процессах биологического окисления. Участие митохондрий в процессах биологического окисления
Главная особенность ОВР в тканях - это их многоступенчатость: образование множества различных промежуточных продуктов. При этом все биохимические окислительно-восстановительные процессы: гликолиз, р-окисление жирных кислот, цикл Кребса, окислительное фосфорилирование и другие - включают много различных стадий, каждая из которых совершается под действием определенных ферментов. Все необходимые ферменты для каждой стадии данного процесса объединены за счет межмолекулярных связей в ансамбли с четкой пространственной организацией. Ансамбли ферментов, как правило, фиксируются на различных клеточных мембранах. В результате слаженного во времени и пространстве действия всех ферментов ансамбля химические превращения субстрата осуществляются постепенно, как на конвейере. При этом продукт реакции одной стадии является исходным соединением для следующей стадии.
Оксидоредуктазы
Ферменты этого класса катализируют окислительно-восстановительные реакции, лежащие в основе биологического окисления. Класс насчитывает 22 подкласса. Коферментами этого класса являются НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоевая кислота.
Примером подклассов могут служить ферменты, действующие на СН-ОН-группу доноров, на СH-СН-группу доноров, на СН-NН2-группу доноров, на гемсодержащие доноры.
Наиболее распространены следующие рабочие названия оксидоредуктаз:
1. Дегидрогеназы – оксидоредуктазы, катализирующие дегидрирование субстрата с использованием в качестве акцептора водорода любых молекул, кроме кислорода.
2. Если перенос водорода от молекулы донора трудно доказуем, то такие оксидоредуктазы называют редуктазами.
3. Оксидазы – оксидоредуктазы, катализирующие окисление субстратов с молекулярным кислородом в качестве акцептора электронов без включения кислорода в молекулу субстрата.
4. Монооксигеназы – оксидоредуктазы, катализирующие внедрение одного атома кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
5. Диоксигеназы – оксидоредуктазы, катализирующие внедрение 2 атомов кислорода в молекулу субстрата с молекулярным кислородом в качестве донора кислорода.
6. Пероксидазы – оксидоредуктазы, катализирующие реакции с пероксидом водорода в качестве акцептора электронов.
Тканевое дыхание происходит в митохондриях. Митохондрии находятся в цитоплазме клеток (кроме эритроцитов). Размер их: 2-3мкм вдлину и около 1 мкм в ширину. 1 клетка печени содержит 1000 митохондрий.
---
Современное представление о тканевом дыхании. Субстраты тканевого дыхания. Дыхательная цепь митохондрий и ее характеристика: пиридинзависимые и флавинзависимые дегидрогеназы, убихинон (коэнзим Q), цитохромы. Химическое строение, участие в транспорте электронов на кислород.
Всего цепь переноса электронов (англ. electron transport chain) включает в себя разнообразные белки, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ.
1-ый комплекс. НАДН-КоQ-оксидоредуктаза
Этот комплекс также имеет рабочее название НАДН-дегидрогеназа, содержит ФМН, 42 белковых молекулы, из них не менее 6 железосерных белков.
Функция:
1. Принимает электроны от НАДН и передает их на коэнзим Q (убихинон).
2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
2 комплекс. ФАД-зависимые дегидрогеназы
Данный комплекс как таковой не существует, его выделение условно. К нему относятся ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (β-окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса атомов водорода).
Функция:
1. Восстановление ФАД в окислительно-восстановительных реакциях.
2. Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q (убихинон)
3 комплекс. КоQ-цитохром c-оксидоредуктаза
По другому данный комплекс называется цитохром с редуктаза. В его составе имеются молекулы цитохрома b и цитохрома c1, железо-серные белки. Комплекс представляет собой 2 мономера, в каждом из которых насчитывается 11 полипептидных цепей.
Функция:
1. Принимает электроны от коэнзима Q и передает их на цитохром с.
2. Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
4 комплекс. Цитохром с-кислород-оксидоредуктаза
В этом комплексе находятся цитохромы а и а3, он называется также цитохромоксидаза, состоит из 13 субъединиц. В комплексе имеются ионы меди, соединенные с белками комплекса через HS-группы цистеина, и формирующие центры, подобные тем, что имеются в железо-серных белках.
Функция:
1. Принимает электроны от цитохрома с и передает их на кислород с образованием воды.
2. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны.
5 комплекс
Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы:
- одна группа формирует субъединицу Fo (произносится со звуком "о", а не "ноль" т.к олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс.
- другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ.
Механизм работы АТФ-синтазы получил название вращательный катализ.
---
Окислительное фосфорилирование как основной механизм синтеза АТФ в животных клетках. Этапы, регуляция. Причины гипоэнергетических состояний. Разобщители и ингибиторы окислительного фосфорилирования, механизм их действия
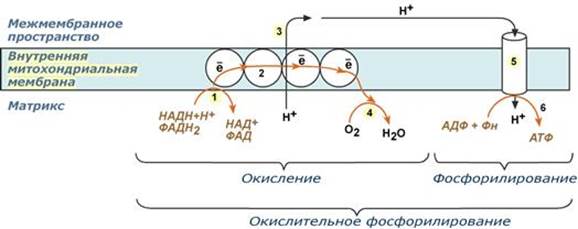
Окислительное фосфорилирование – это многоэтапный процесс, происходящий во внутренней мембране митохондрий и заключающийся в окислении восстановленных эквивалентов (НАДН и ФАДН2) ферментами дыхательной цепи и сопровождающийся синтезом АТФ.
Впервые механизм окислительного фосфорилирования был предложен Питером Митчеллом. Согласно этой гипотезе перенос электронов, происходящий во внутренней митохондриальной мембране, вызывает выкачивание ионов Н+ из матрикса митохондрий в межмембранное пространство. Это создает градиент концентрации ионов Н+ между цитозолем и замкнутым внутримитохондриальным пространством. Ионы водорода в норме способны возвращаться в матрикс митохондрий только одним способом – через специальный фермент, образующий АТФ – АТФ-синтазу.
По современным представлениям внутренняя митохондриальная мембрана содержит ряд мультиферментных комплексов, включающих множество ферментов. Эти ферменты называют дыхательными ферментами, а последовательность их расположения в мембране – дыхательной цепью или электрон-транспортной цепью (англ. electron transport chain).
В целом работа дыхательной цепи заключается в следующем:
1. Образующиеся в реакциях катаболизма НАДН и ФАДН2 передают атомы водорода (т.е. протоны водорода и электроны) на ферменты дыхательной цепи.
2. Электроны движутся по ферментам дыхательной цепи и теряют энергию.
3. Эта энергия используется на выкачивание протонов Н+ из матрикса в межмембранное пространство.
4. В конце дыхательной цепи электроны попадают на кислород и восстанавливают его до воды.
5. Протоны Н+ стремятся обратно в матрикс и проходят через АТФ-синтазу. При этом они теряют энергию, которая используется для синтеза АТФ
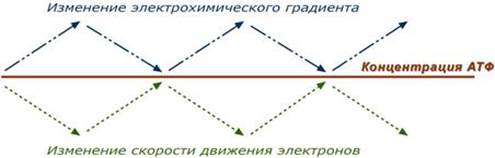
Дыхательный контроль – это прямое ингибирующее влияние электрохимического градиента на скорость движения электронов по дыхательной цепи (т.е. на величину дыхания). В свою очередь, величина градиента напрямую зависит от соотношения АТФ / АДФ, количественная сумма которых в клетке примерно постоянна ([АТФ] + [АДФ] = const). Реакции катаболизма направлены на поддержание постоянно высокого уровня АТФ и низкого АДФ.
Причиной гипоэнергетических состояний может быть следующее:
- гиповитаминозы экзогенные и/или эндогенные – снижается скорость и эффективность окислительных реакций. Возникает обычно при нехватке витаминов – В1, В2, никотиновой кислоты, В6, пантотеновой кислоты и аскорбиновой кислоты,
- дефицит белка в пище – снижается синтез всех ферментов и ферментов катаболизма в частности,
- снижение потребления углеводов и липидов как основных источников энергии,
- дефицит кислорода – отсутствие акцептора для электронов вызывает "переполнение" дыхательных ферментов, накопление НАДН и ФАДН2 в клетке и прекращение катаболизма,
- дефицит железа – компонента цитохромов, миоглобина и гемоглобина, и меди – компонента цитохромоксидазы.
Разъединение (разобщение) процессов окисления и фосфорилирования осуществляют вещества, называемые разобщители. Они снижают величину электрохимического градиента, что приводит к уменьшению синтеза АТФ, несмотря на увеличение скорости движения электронов по дыхательной цепи и возрастание катаболизма.
К разобщителям в первую очередь относят " протонофоры " – молекулы, переносящие ионы водорода из межмембранного пространства в матрикс митохондрии. При этом одновременно уменьшаются оба компонента электрохимического градиента – электрический и химический, и энергия градиента не используется для синтеза АТФ, а рассеивается в виде тепла. Следствием эффекта протонофоров является возрастание катаболизма жиров и углеводов в клетке.
Классическим экспериментальным протонофором является динитрофенол, жирорастворимое соединение, присоединяющий ионы водорода на внешней поверхности внутренней митохондриальной мембраны и отдающий их на внутренней поверхности. Физиологическими протонофорами являются особые разобщающие белки, в частности термогенин.
Кроме динитрофенола и термогенина протонофорами, к примеру, являются салицилаты, дикумарол, жирные кислоты, непрямой билирубин, трийодтиронин.
---
Митохондрии, особенности строения мембран митохондрий. Комплексы дыхательной цепи: состав, топология, участие в процессах биологического окисления. Митохондриальный синтез АТФ. АТФ- синтетаза. Сопряжение процессов тканевого дыхания и фосфорилирования.
Наружная мембрана митохондрий содержит много молекул специализированных транспортных белков (например, порин), что обеспечивает её высокую проницаемость, а также белки-рецепторы, распознающие белки, которые переносятся через обе мембраны митохондрий в особых точках их контакта – зонах слипания.
Внутренняя мембрана митохондрий образует складки – кристы, благодаря чему значительно увеличивается внутренняя поверхность митохондрий. В состав внутренней мембраны входят транспортные белки; ферменты дыхательной цепи и сукцинатдегидрогеназа; комплекс АТФ-синтетазы. На кристах имеются элементарные частицы (оксисомы, или F1-частицы), состоящие из округлой головки (9 нм) и цилиндрической ножки. Именно на них происходит сопряжение процессов окисления и фосфорилирования (АДФ → АТФ).
Чаще всего кристы располагаются перпендикулярно длинной оси митохондрий и имеют пластинчатую (ламеллярную) форму. В клетках, синтезирующих стероидные гормоны, кристы имеют вид трубочек или пузырьков - тубулярно-везикулярные кристы. В этих клетках ферменты стероидного синтеза частично локализуются на внутренней мембране митохондрий
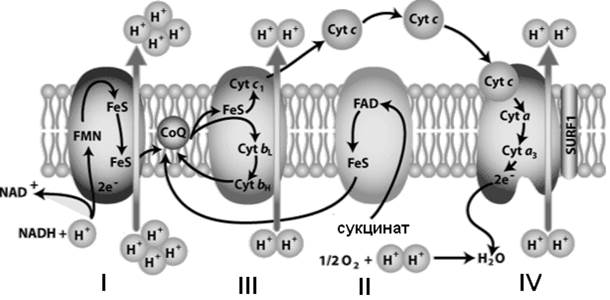
Комплекс I (НАДН-дегидрогеназа) включает ФМН и железосерный белок FeS (негемовое железо). Железосерный белок участвует в окислительно-восстановительном процессе. Комплекс I окисляет НАДН, перенося с него 2 электрона на кофермент Q (KоQ) и перекачивает 4 протона из матрикса в межмембранное пространство митохондрии.
KoQ(убихинон) - производное бензохинона. Это некрупная липофильная молекула. Перемещаясь в липидном слое мембраны, убихинон обеспечивает передачу электронов между комплексами I - III и II - III.
Комплекс II (сукцинат-дегидрогеназа) включает ФАД и железосерный белок. Обеспечивает вход в цепь дополнительных электронов за счет окисления сукцината.
Комплекс III (QН2-дегидрогеназа) включает цитохромы b и с1 и железосерный белок. Цитохромы- гемопротеины, в которых простетическая геминовая группа близка к гему гемоглобина (у цитохрома b идентична). Комплекс III переносит электроны с убихинона на цитохром с и перекачивает 2 протона в межмембранное пространство.
Комплекс IV (цитохром c оксидаза) состоит из цитохромов a и a3, которые, помимо гема, содержат ионы меди. Комплекс IV катализирует перенос электронов с молекул цитохрома на O2 и перекачивает 4 протона в межмембранное пространство.
АТФ-синтаза (Н+-АТФ-аза) - интегральный белок внутренней мембраны митохондрий. Он расположен в непосредственной близости к дыхательной цепи. АТФ-синтаза состоит из 2 белковых комплексов, обозначаемых как F0 и F1.
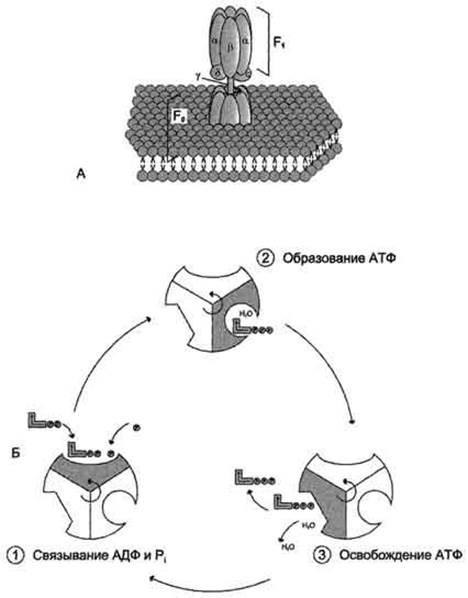
А - F0 и F1 - комплексы АТФ-синтазы, В состав F0 входят полипептидные цепи, которые образуют канал, пронизывающий мембрану насквозь. По этому каналу протоны возвращаются в матрикс из межмембранного пространства; белок F1 выступает в матрикс с внутренней стороны мембраны и содержит 9 субъединиц, 6 из которых образуют 3 пары α и β ("головка"), прикрывающие стержневую часть, которая состоит из 3 субъединиц γ, δ и ε. γ и ε подвижны и образуют стержень, вращающийся внутри неподвижной головки и связанный с комплексом F0. В активных центрах, образованных парами субъединиц α и β, происходит связывание АДФ, неорганического фосфата (Рi) и АТФ. Б - Каталитический цикл синтеза АТФ включает 3 фазы, каждая из которых проходит поочерёдно в 3 активных центрах: 1 - связывание АДФ и Н3РО4; 2 - образование фосфоангидридной связи АТФ; 3 - освобождение конечного продукта. При каждом переносе протонов через канал F0 в матрикс все 3 активных центра катализируют очередную фазу цикла. Энергия электрохимического потенциала расходуется на поворот стержня, в результате которого циклически изменяется конформация α- и β-субъединиц и происходит синтез АТФ.
---
 2020-08-05
2020-08-05 3604
3604







