Реакция взаимодействия металла с водой может быть выражена следующей схемой:
_
ne


Me + OH → Me(OH)x + H2
т.е. металл вытесняет водород из воды.
Эта реакция возможна при условии, если потенциал металла
φMe/Men < - 0,0414B
Наиболее энергично эта реакция протекает при взаимодействии воды с щелочными и щелочноземельными металлами
2K + 2H2O = 2KOH + H2
Ko – e → K+ | 2 окисление
2H+ + 2e → H2|1 восстановление
2Na + 2H2O = 2NaOH + H2
Nao – e → Na+ | 2 окисление
2H+ + 2e → H2 | 1 восстановление
Ba + 2H2O = Ba(OH)2 + H2
Bao - 2e → Ba2+ | 1
2H+ + 2e → H2 | 1
Многие металлы, потенциал которых меньше – 0.414, не вытесняют водород из воды (магний, цинк, алюминий и т.д.). Это объясняется тем, что они образуют плохо растворимые в воде гидроксиды, которые оседают на поверхности и создают на ней прочные защитные пленки.
Mg + 2H2O = ↓ Mg(OH)2 + H2
Zn + 2H2O = ↓ Zn(OH)2 + H2
При действии водяных паров на раскаленное железо протекает процесс:
3Fe + 4H2O ↔ Fe3O4 + 4H2
Металлы, потенциал которых φ > - 0.414 не способны вытеснять водород из воды.
Отношение металлов к кислотам
Почти все металлы окисляются кислотами. Характер взаимодействия металла с кислотой зависит как от активности металла, так и от свойств и концентрации кислоты.
3.3.1 Взаимодействие металлов с кислотами, окислителем в которых является катион водорода.
(HCl, HBr, H3PO4, H2SO4(разбав.))
восстановитель Meo – ne → Men+
окислитель 2H+ + 2e → H2
Реакция взаимодействия металлов с перечисленными выше кислотами сводится к вытеснению водорода из кислоты.
В данных средах способны разрушаться металлы, φо которых меньше нуля, т.е. в ряду напряжения эти металлы стоят выше водорода, при условии, что продукты взаимодействия их с кислотой не образуют нерастворимых веществ, которые способны выполнять защитную функцию:
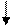
 e
e
Zn + 2HCl = ZnCl2 + H2 φoZn / Zn2+ = - 0.76B
Pb + H2SO4 разб ≠ ↓ PbSO4 + H2 φoPb / Pb2+ = - 0.14B
3Fe + 2H3PO4 = ↓Fe3PO4 + 3H2 φoFe / Fe3+ = - 0.44B
Feo – 2e → Fe2+ |
2H+ + 2e → H2 |
Фосфат железа (II) образует на поверхности железа защитную пленку, поэтому в фосфорной кислоте железо не разрушается.
Ni + H2SO4 разб = NiSO4 + H2 (φoNi / Ni2+ = - 0.25B)
Cu + H2SO4 ≠ процесс не протекает,
т.к. φoCu / Cu2+ = +0.34.
Схема
Ме до водорода

 Н2 + соль в низшей степени
Н2 + соль в низшей степени
окисления
Me + HCl →
H2SO4
(разб)
H3PO4
 Реакция не идет.
Реакция не идет.
Me за водородом
 2020-08-05
2020-08-05 404
404








